题目内容
【题目】某兴趣小组的同学们围绕“酸碱中和反应”,将学生成分若干小组开探宂活动。请你和他们一起完成以下实验探究。
(提出问题一)稀硫酸与氢氧化钠溶液能否发生反应
(实验探究1)甲组同学在烧杯中加入10mL稀硫酸。滴入几滴酚酞试液,接着分两次向烧杯中滴入氢氧化钠溶液。第一次滴加几滴氢氧化钠溶液后,不断搅拌,第二次继续滴加氢氧化钠溶液至过量。则第一次滴加氢氧化钠溶液时,溶液中溶质(不考虑酚酞)的质量变化情况是(1)_________;第二次滴加氢氧化钠溶液时观察到的现象是(2)_________。由上述实验甲组同学得出了稀硫酸与氢氧化钠溶液能发生反应的结论。反应的化学方程为(3)________。
(提出问题二)是否可以用其他试剂证明稀硫酸与氢氧化钠溶液能发生反应呢?
(实验探究2)同学们想要利用找到的生锈的铁钉继续探究,并设计了如下实验方案。
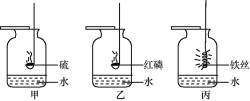
乙组同学的实验过程如图所示:向a试管中滴加氢氧 化钠溶液时无明显现象,再将混合后的溶液倒入盛有生锈铁钉的另一试管中,观察到(4)______的明显现象。
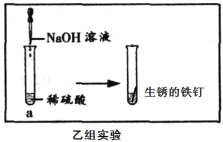
乙组结论:生锈的铁钉可以证明稀硫酸与氢氧化钠溶液能发生反应。
丙组同学的实验过程与乙组相同,但是丙组同学却未观察到明显现象。
丙组结论:生锈的铁钉可以证明稀硫酸与氢氧化钠溶液能发生反应。
(交流讨论)你认为乙、丙两组中哪个小组由实验现象获得的结论是正确的,并说明理由(5)_________。
(反思)若化学反应无明显现象时,可通过证明(6)________来判断有化学反应发生。
【答案】硫酸逐渐减少,硫酸钠逐渐增多 溶液由无色变为红色 2NaOH + H2SO4 = Na2SO4 + 2H2O 红褐色固体逐渐减少,溶液由无色变黄色 丙;加入生锈的铁钉无变化 ,说明溶液中没有稀硫酸,证明稀硫酸以被氢氧化钠消耗 有新物质生成或反应物消失
【解析】
(1)随着硫酸与氢氧化钠反应生成硫酸钠和水这一反应的进行,溶液中的溶质H2SO4逐渐减少,Na2SO4逐渐增多;
(2)酸和中性物质都不能使酚酞变色,所以开始溶液为酸性,溶液为无色;当滴加的氢氧化钠恰好和硫酸反应时溶液中性,也不变色;当第二次氢氧化钠过量后,溶液中除硫酸钠这种中性物质外还有氢氧化钠这种碱性物质,故溶液变红色;
(3)稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,反应的化学方程为:2NaOH+H2SO4=Na2SO4+2H2O;
(4)铁锈中的氧化铁和硫酸反应生成硫酸铁和水,此反应的现象是:红褐色固体逐渐减少,溶液由无色变黄色;
(5)因为铁锈中的氧化铁和硫酸反应,会出现红褐色固体逐渐减少,溶液由无色变黄色;丙组:加入生锈的铁钉无变化 ,说明溶液中没有稀硫酸,证明稀硫酸以被氢氧化钠消耗,故正确;
(6)根据以上实验分析可知:化学反应无明显现象时,可通过证明有新物质生成或反应物消失来判断有化学反应发生。

 备战中考寒假系列答案
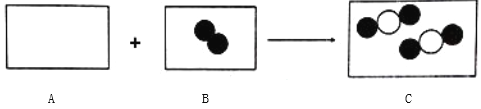
备战中考寒假系列答案【题目】物质丙是重要的化工产品,在国民经济中占有重要地位。工业上用甲和乙合成丙。甲、乙、丙的微观示意图见下表。请完成下列空白。
物质 | 甲 | 乙 | 丙 |
|
微观示意图 |
|
|
|
(1)甲、乙、丙3种物质都是由 (填“分子”“原子”或“离子”)_____构成的。
(2)甲、乙、丙中属于化合物的是_____。
(3)物质丙中氮元素的化合价为_____。
(4)丙中氮、氢元素的质量比为_____。
(5)写出甲和乙在高温、高压、催化剂的条件下合成丙的化学方程式:_____。