题目内容
同学们在学习了木炭还原氧化铜的实验后,联想到单质碳的一些化学性质,对反应后的气体成分产生了疑问,某学习小组对该反应产物中的气体成分进行了探究.〔猜想〕
①气体产物全部是CO2②气体产物全部是CO③气体产物______
〔查阅资料〕CO气体能使湿润的黄色氯化钯试纸变蓝色.
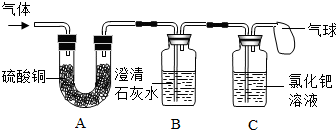
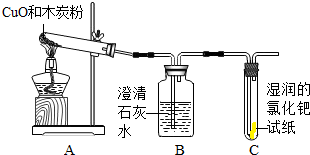
〔设计实验〕根据各自的猜想,他们共同设计了如下图的实验装置进行探究.
〔现象与分析〕
〔结论〕实验现象证明猜想③成立,同学们的疑问是合理的.
〔反思〕
(1)同学们对CO产生的原因进行了分析:
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
②原因二:反应C+2CuO
2Cu+CO2↑中的一种产物和反应物木炭又发生了化学反应,产生了CO;
请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理______.
(2)根据上述实验,请你归纳出单质碳在工业上的重要用途______.
①气体产物全部是CO2②气体产物全部是CO③气体产物______
〔查阅资料〕CO气体能使湿润的黄色氯化钯试纸变蓝色.
〔设计实验〕根据各自的猜想,他们共同设计了如下图的实验装置进行探究.

〔现象与分析〕
| 现象 | 结论 |
| 如果装置B______,装置C无现象 | 则猜想①成立 |
| 如果装置B无现象,装置C______ | 则猜想②成立 |
| 如果装置B______,装置C______ | 则猜想③成立 |
〔反思〕
(1)同学们对CO产生的原因进行了分析:
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
②原因二:反应C+2CuO
| ||
请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理______.
(2)根据上述实验,请你归纳出单质碳在工业上的重要用途______.
猜想:木炭粉与氧化铜反应生成物有三种可能:①气体产物全部是CO2②气体产物全部是CO③气体产物是CO2和CO的混合物;
现象与分析:根据猜想①成立,气体全部是二氧化碳,则澄清的石灰水变浑浊;若猜想②成立,气体产物全部是CO,则试纸由黄色变为蓝色;猜想③成立,则装置B澄清石灰水变浑浊,装置C试纸由黄色变为蓝色;
反思:(1)木炭和氧化铜在高温条件下直接发生反出产生CO,方程式是:CO2+C
2CO;反应C+2CuO
2Cu+CO2↑中的一种产物和反应物木炭又发生了化学反应,产生了CO,方程式是:CuO+C
Cu+CO↑;
(2)根据碳具有还原性,工业上可用碳冶炼金属;
故答案为:〔猜想〕是CO2和CO的混合物;
〔现象与分析〕
〔反思〕
(1)CO2+C
2CO或CuO+C
Cu+CO↑;
(2)冶炼金属.
现象与分析:根据猜想①成立,气体全部是二氧化碳,则澄清的石灰水变浑浊;若猜想②成立,气体产物全部是CO,则试纸由黄色变为蓝色;猜想③成立,则装置B澄清石灰水变浑浊,装置C试纸由黄色变为蓝色;
反思:(1)木炭和氧化铜在高温条件下直接发生反出产生CO,方程式是:CO2+C
| ||
| ||
| ||
(2)根据碳具有还原性,工业上可用碳冶炼金属;
故答案为:〔猜想〕是CO2和CO的混合物;
〔现象与分析〕
| 现象 | 结论 |
| 如果装置B 澄清石灰水变浑浊,装置C无现象 | 则猜想①成立 |
| 如果装置B无现象,装置C 试纸由黄色变为蓝色 | 则猜想②成立 |
| 如果装置B 澄清石灰水变浑浊,装置C 试纸由黄色变为蓝色 | 则猜想③成立 |
(1)CO2+C
| ||
| ||
(2)冶炼金属.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目