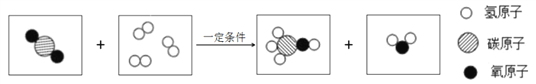
题目内容
【题目】纯碱在工业上有广泛的应用。实验室模拟工业上利用饱和食盐水生产纯碱的流程图是:
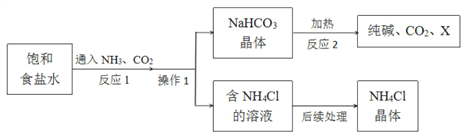
回答下列问题:
(1)反应 1 的化学方程式为________________________________________。
(2)操作 1 中,需要用到的玻璃仪器除漏斗、玻璃棒外,还有______________。
(3)纯碱的化学式为_________,X的化学式为________。
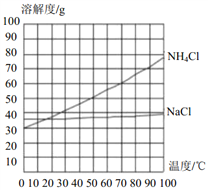
(4)“后续处理”主要包括蒸发浓缩、_________、过滤等操作,参考如图的溶解度曲线分析,采用这些操作方法的原因是___________________________。
(5)写出 NH4Cl 的一种用途_____。
【答案】 NaCl + NH3 + CO2 + H2O == NaHCO3↓ + NH4Cl 烧杯 Na2CO3 H2O 降温结晶 NH4Cl的溶解度随温度的降低而减小 用作氮肥
【解析】(1). 氨气、水】二氧化碳7氯化钠四种物质反应生成碳酸氢钠和氯化铵,方程式为:NaCl + NH3 + CO2 + H2O == NaHCO3↓ + NH4Cl (2). 过滤操作需要的玻璃仪器除漏斗、玻璃棒外,还有烧杯 (3). 碳酸钠俗称纯碱,化学式为Na2CO3 (4). 由反应方程式可知X是H2O (5). 由溶解度曲线图可知,NH4Cl的溶解度随温度的降低而减小 ,而氯化钠的溶解度受温度很小,降温时氯化铵大部分析出,而氯化钠不析出,所以可用降温结晶 提纯氯化铵; (7). 氯化铵含有氮元素,可用作氮肥

【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,某研究性学习小组模拟生产企业制取氢化钙。
【查阅资料】
I、白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ、碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ、钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅳ、钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水。
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)同学们设计了以下实验装置:
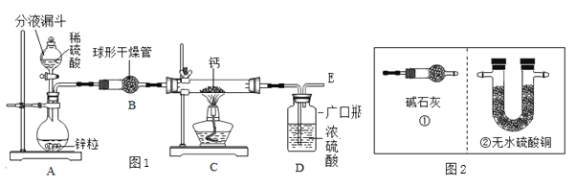
请回答:
①装置A中发生反应的化学方程式为____________________;为了实验安全,点燃C装置酒精灯前应先__________________;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的__________(选填:①或②)装置;
③图1装置D中浓硫酸的作用是__________________;
【进行实验)过程略
【验证产物】略
【实验拓展】(2)定性实验用化学方法鉴别Ca与Ca比,完成下表中内容。
实验步骤 | 预期现象和结论 |
取少量固体样品,在干燥条件下与氧气反应,将其产物通入装有无水硫酸铜的干燥管; | ___________________ |
(3)定量实验:测定Ca和CaH2混合物中CaH2的质量分数。
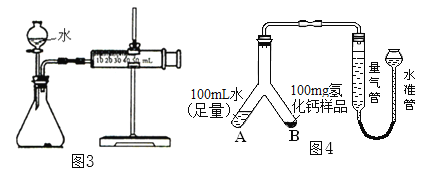
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在_______时进行收集(选填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是___________________;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL。将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL。已知该实验条件下,氢气的密度为0.09mg/mL。样品中氢化钙的质量分数为_______________;(结果精确到0.1%)
【反思与交流】
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?
你的观点是________________________。