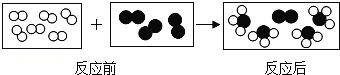
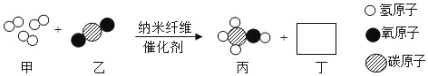
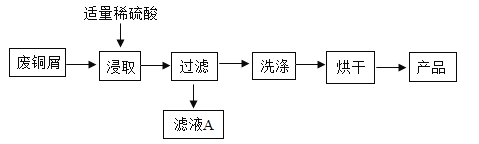
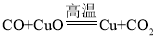题目内容
【题目】水是人类生活中不可缺少的物质.

(1)目前部分农村的饮用水,主要是取地下水,可用 检验地下水是硬水还是软水,常用 方法降低水的硬度.
(2)净水时,通常用 的方法,除去水中难溶性杂质,常用 做吸附剂除去水中的色素和异味.
(3)龚辉同学设计了电解水简易装置,其中A、B电极由金属曲别针制成.通电后的现象如图所示.与A电极相连的试管中收集到的气体是 ;电解水的化学方程式为:
(4)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一.Ca(HCO3)2受热分解的化学方程式为 .
【答案】(1)肥皂水;煮沸;(2)过滤;活性炭;
(3)氢气;2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
(4)Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑.
CaCO3↓+H2O+CO2↑.
【解析】(1)硬水中加入肥皂水产生泡沫少,软水中加入肥皂水产生泡沫多,因此可用肥皂水进行区分;生活中常用加热煮沸的方法来降低水的硬度;
(2)过滤是把水中不溶性杂质除去的方法.因此,可用过滤的方法除去水中不溶性杂质;常用活性炭做吸附剂除去水中的色素和异味.
(3)电解水时与正极相连的试管中生成的气体较少是氧气,电解水的化学方程式为:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(4)依据题干中的信息结合化学方程式的书写要求可知:Ca(HCO3)2受热分解的化学方程式为:Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑.
CaCO3↓+H2O+CO2↑.

【题目】某班两组同学利用稀硫酸和氢氧化钠溶液进行了如下实验:
(1)第一小组同学测量9.8%的稀硫酸和10%的氢氧化钠溶液中和反应过程中温度的变化。
①第一步:关于溶液的配制和保存
首先,该小组同学将配制好的10%的氢氧化钠溶液,倒入带_____塞的细口瓶中,备用。其次,该组同学用如表标签所示的浓硫酸配制100g溶质质量分数为9.8%的稀硫酸。请列式计算所需水的体积_____。
硫酸
化学式H2SO4
相对分子质量98
质量分数98%
本试剂为无色透明的粘稠液体
有腐蚀性!
②该小组同学量取了8组均为8mL的氢氧化钠溶液,分别向其中加入一定体积的稀硫酸,测得温度变化如表所示:
实验组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
加入稀硫酸的体积 (V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液温度上升 (△t)/℃ | 4.8 | 8.4 | 11.2 | 11.1 | 13.1 | 11.4 | 10.2 | 9.2 |
其中实验组别为_____(填实验组别的序号)的一组数据明显不合理,判断理由是_____。
(2)第二小组同学计划探究中和反应过程中的pH变化情况。他们取稀释后的氢氧化钠溶液25g,向其中加入溶质质量分数为9.8%的稀硫酸,加入稀硫酸的质量与溶液pH的变化情况如图所示。计算:
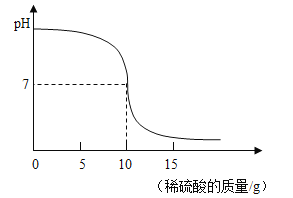
①当两者恰好完全中和时,所得溶液中溶质的质量分数_____。(计算结果精确到0.1%)
②已知:20℃时硫酸钠的溶解度为19.5g。若要将反应后所得溶液恰好转化为20℃时的饱和溶液,最简单的方法是_____。