题目内容
【题目】某实验室有一瓶久置的废铜屑,表面生成绿色的铜锈(主要成分Cu(OH)2CO3)实验组准备对钢锈进行处理并回收钢,过程如下。
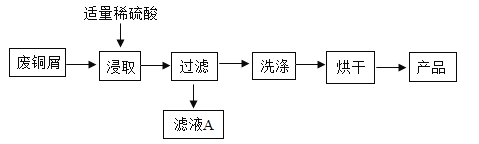
回答下列问题:
(1)“浸取”时反应产生的气体为_____;“过滤”时需要的玻璃仪器有烧杯、玻璃棒和_____。
(2)滤液A为硫酸铜溶液,其中铜离子是重金属离子,随意排放会污染环境。可向滤液中加入适量_____(填序号),充分反应后过滤,滤渣干燥保存滤液倒入下水道。
A BaCl2溶液 B NaOH溶液 C HCl溶液
(3)若用铁粉去置换滤液A中的铜经测定滤液A的溶质质量分数为20%,若现有1.6千克的滤液,完全反应至少需要铁粉的质量为多少?____(写出计算过程)
【答案】二氧化碳 漏斗 B 0.112kg
【解析】
(1)“浸取”时由于是硫酸与碳酸盐反应,所以一定生成二氧化碳,所以反应产生的气体为 二氧化碳;“过滤”时需要的玻璃仪器有烧杯、玻璃棒和 漏斗。
(2)滤液A为硫酸铜溶液,其中铜离子是重金属离子,随意排放会污染环境。所以要除去铜离子。给出的试剂中只有氢氧化钠溶液和铜离子反应生成氢氧化铜沉淀。所以可向滤液中加入适量的氢氧化钠溶液。故选B。
(3)滤液所含的硫酸铜的质量为1.6kg×20%=0.32kg
设参加反应的铁的质量为x
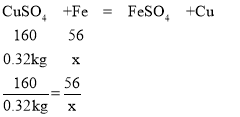
x=0.112kg
故答案为:
(1 ) 二氧化碳;漏斗。(2)B。(3)0.112kg

练习册系列答案
相关题目