题目内容
【题目】对比、分析、归纳是学习化学的重要方法。
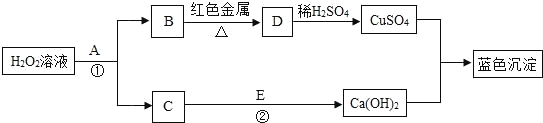
已知已知H2、CO、C是初中化学常见的还原剂,H2、CO、C都可以与金属氧化物(如氧化铜)发生反应,请分析下列反应:
⑴ ![]()
⑵ 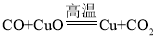
⑶ 
在⑴中:氢元素的化合价由反应前的________价变成反应后________价,同理分析在⑵ ⑶两个反应中,CO、C中的碳元素在反应后化合价________(选填“升高”或“降低”或“不变”)。
(2)依据上述分析,则在反应SO2+2H2S=3S↓+2H2O中作为氧化剂的物质是________;
【答案】0 +1 升高 SO2
【解析】
根据题意,结合单质中元素的化合价为0、在化合物中正负化合价代数和为零,分析还原剂在化学反应前后元素化合价的变化,进行分析解答.
(1)由化学方程式H2+CuO ![]() Cu+H2O;Fe2O3+3CO
Cu+H2O;Fe2O3+3CO![]() 2Fe+3CO2;C+O2
2Fe+3CO2;C+O2 ![]() CO2;
CO2;
H2、C属于单质,氢元素和碳元素的化合价为0;CO中氧元素显2价,碳元素显+2价;生成物水、二氧化碳中,水中氢元素显+1价,二氧化碳中碳元素显+4价;则物质(如H2、CO、C)作还原剂时,所含元素中,一定有元素的化合价在反应后升高。故填:0 +1 升高;
(2)根据化学方程式SO2+2H2S=3S↓+2H2O可以看出,二氧化硫中硫元素的化合价反应后降低,氧元素的化合价不变,故二氧化硫是氧化剂;硫化氢中氢元素的化合价反应前后不变,硫元素的化合价由反应前的2价变为0价,化合价升高,故硫化氢是还原剂;故填:SO2。

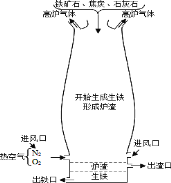
【题目】某班学生在老师指导下探究铁与水蒸气的反应。
(1)按图甲装好药品,连接装置(夹持仪器已略去)。其中A装置的作用是________。
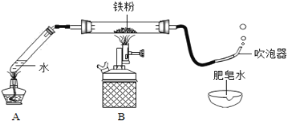
(2)加热一段时间后,灰色铁粉逐渐变黑,吹泡器连续吹出气泡,且气泡向上飞起;用燃着的木条靠近气泡,能产生爆鸣。该气体燃烧的化学方程式为_____________。
(3)同学们讨论后认为:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
(查阅资料)铁有三种氧化物(FeO、Fe2O3、Fe3O4),其中FeO接触到空气会立即由黑色变为红棕色;铁的三种氧化物都不与硫酸铜溶液反应。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
倒出玻璃管中黑色固体,平铺于白纸上 | 黑色固体不变色 | 黑色固体中一定没有____(填物质名称) |
取上述黑色固体少许,装入试管,加入足量____溶液 | ________,且有红色固体出现 | 黑色固体中一定含有__________ |
(探究结论)铁与水蒸气发生置换反应,有关的化学方程式是________________________。
【题目】维生素C(简称Vc,又名抗坏血酸)易溶于水,水溶液呈酸性,易被O2、I2(碘)氧化。某同学为了探究Vc的性质,进行了如下实验。
实验1:用某制药厂生产的Vc片(每片含Vc0.1g及不溶性辅料)配制0.5%的Vc溶液。
(1)若取5片Vc片,应大约取蒸馏水____mL(取整数)
(2)量取蒸馏水除了用到量筒外还需用到的仪器是_____。
实验2:设计实验证明 Vc 溶液具有酸性。
(3)限用试剂:无色酚酞溶液、稀氢氧化钠溶液。请你完成下表。
实验步骤 | 预期现象及结论 |
_______ | _______,说明Vc溶液具有酸性 |
实验3:探究Vc溶液在一定温度下(18℃)露置时间对Vc含量的影响,采用控制变量法进
行实验,具体如下表所示。 (信息提示:淀粉与碘作用显蓝色。往碘水中加入几滴淀粉溶液,然后逐滴加入Vc溶液,当溶液的蓝色褪去,说明碘与Vc恰好完全反应。)
实验 序号 | 碘水浓度 及用量 | 淀粉溶液 | Vc 溶液恒温露置时间/h | 蓝色消失需要 Vc 溶液滴数 |
① | 0.06%、4.8mL | 3 滴 | 0 | 10 |
② | 0.06%、4.8mL | 3 滴 | 12 | 12 |
③ | 3 滴 | 24 | 18 | |
④ | 0.06%、4.8mL | 3 滴 | 36 |
(4)实验③中碘水浓度及用量分别是_____。
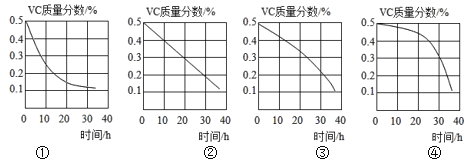
(5)Vc质量分数随露置时间(0~36h)的变化图像,正确的是____(填图像标号)。
(6)为了提高定量探究Vc溶液的准确性,配制Vc溶液时,必须先除去溶解在蒸馏水中的少量O2,具体处理方法是_____。