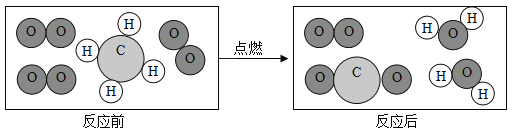
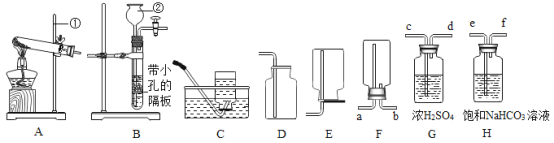
题目内容
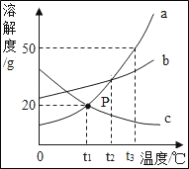
【题目】下图为a、b、c三种物质的溶解度曲线
①t2°C 时将30ga物质加入到50g水中,充分溶解,所得溶液的质量为_____.
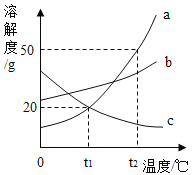
②将t2°C时a、b、c三种物质的饱和溶液降温到t1°C,所得溶液中溶质的质量分数大小关系为_____.
【答案】75g bac
【解析】
①由溶解度曲线可知t2°C 时,a物质的溶解度为50g,即100g水中最多能够溶解50g物质a,将30ga物质加入到50g水中,充分溶解,只能溶解25ga物质,所得溶液的质量为![]() ;
;
②在t2°C时,三种物质的溶解度大小关系是abc,即在t2°C时,三种物质的饱和溶液中溶质的质量分数:abc;由于a和b的溶解度随温度的降低而减小,因此降温至时,a和b的溶液中都会有晶体析出,溶液都还是饱和溶液,在t1°C时三种物质的溶解度ab=c,而由于c的溶解度随温度的降低而增大,因此降温至t1°C时,其饱和溶液就会变成不饱和溶液,但溶液中溶质的质量分数不变,t1°C时b的溶解度大于t1°C时a的溶解度大于t2°C时c的溶解度,所得溶液溶质质量分数大小的比较,其关系是bac。

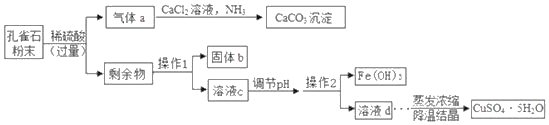
【题目】以孔雀石为原料制取胆矾(CuSO45H2O)的部分工艺流程如图所示。
(查阅资料)
I.孔雀石主要成分为Cu2(OH)2CO3,还有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。
Ⅱ.胆矶是一种蓝色晶体,受热易分解。
Ⅲ.在该实验条件下,Fe(OH)3、Cu(OHI)2沉淀的pH如下表:
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.14 | 4.2 |
完全沉淀的pH | 3.0 | 6.7 |
(1)操作1的名称为_____,实验室进行该操作时玻璃棒的作用是_____。
(2)气体a生成CaCO3的同时还生成NH4C1,该反应的化学方程式为_____。
(3)溶液c中的溶质有:CuSO4、H2SO4和_____(写化学式)
(4)为将溶液中的Fe3+全部转化为Fe(OH)3,沉淀而Cu2+不转化为Cu(OH)2沉淀,应调节pH=m,m的范围是_____。
(5)获得胆矾晶体时采用降温结晶而不用蒸发结晶的主要原因是_____。