题目内容
【题目】化学兴趣小组的同学发现实验台上一瓶标签破损的无色溶液(标签如图).经了解得知该无色溶液原存放在盐溶液的柜子里,由此猜测可能是_____,
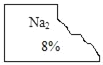
他们提出可能是碳酸钠、碳酸氢钠、硫酸钠 氯化钠、硝酸钠溶液中的一种,于是决定对这瓶溶液进行实验探究。
(理论分析)为了确定该溶液,他首先进行了分析,小组同学根据标签残留部分认为一定不是_____,他们的依据是_____。
(查阅资料)
Na2CO3+HCl=NaCl+NaHCO3 Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑ Na2CO3+BaCl2=BaCO3↓+2NaCl
(活动探究)
为确定其成分,小新同学设计如下方案进行探究(探究1)
实验步骤 | 现象 | 结论 |
该溶液少许于试管中,滴加过量的BaCl2溶液,振荡 | ①_____ | 则该溶液是Na2SO4溶液 |
过滤,向滤渣滴加稀盐酸 | ②_____ |
(2)小芳认为可以设计更简单的实验方案(探究2)
实验步骤 | 现象 | 结论 |
取该无色溶液少许于试管中,慢慢滴加少量的盐酸 | 没有气泡产生 | 溶液中没有碳酸钠,则该溶液是Na2SO4溶液 |
(解释)你认为上面两位同学对实验结果判定是否正确?请说明理由_____。
(实验反思)在区别判断物质成分时,除考虑物质本身的性质外,还需考虑_____。
【答案】盐 碳酸氢钠、氯化钠、硝酸钠 该标签中钠元素右下角的数字是2,而碳酸氢钠、氯化钠和硝酸钠化学式中钠元素右下角的数字是1 产生白色沉淀 沉淀不消失 小新同学的正确,小芳同学的错误,因为加入少量的盐酸时可能是碳酸钠与盐酸反应生成氯化钠和碳酸氢钠 反应物的量
【解析】
该无色溶液原存放在盐溶液的柜子里,由此猜测可能属于盐,故填:盐,
[理论分析]根据标签可以看出,该标签中钠元素右下角的数字是2,而碳酸氢钠、氯化钠和硝酸钠化学式中钠元素右下角的数字是1,故一定不会是碳酸氢钠、氯化钠、硝酸钠,故填:碳酸氢钠、氯化钠、硝酸钠;该标签中钠元素右下角的数字是2,而碳酸氢钠、氯化钠和硝酸钠化学式中钠元素右下角的数字是1。
[活动探究]
硫酸钠能与氯化钡反应生成硫酸钡沉淀,硫酸钡不溶于盐酸,故填:
实验步骤 | 现象 | 结论 |
该溶液少许于试管中,滴加过量的BaCl2溶液,振荡 | ①产生白色沉淀 | 则该溶液是Na2SO4溶液 |
过滤,向滤渣滴加稀盐酸 | ②沉淀不消失 |
(2)[解释]根据题干提供的信息,Na2CO3+HCl=NaCl+NaHCO3,故加入少量的盐酸不会产生气泡,不能说明就是硫酸钠,故填:小新同学的正确,小芳同学的错误,因为加入少量的盐酸时可能是碳酸钠与盐酸反应生成氯化钠和碳酸氢钠。
[实验反思]在区别判断物质成分时,除考虑物质本身的性质外,还需考虑反应物是否过量,故填:反应物的量。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行了以下实验:取出3g合金样品,将60g稀硫酸分为6等份依次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 | 第6份 |
剩余固体质量 | 2.5g | m | 1.5g | 1.0g | 0.6g | 0.6g |
(1)铜镁合金属于_____(填“混合物”或“纯净物“);
(2)加入稀硫酸发生反应的化学方程式为_____;
(3)分析数据可知表格中m=_____;
(4)合金样品中铜的质量分数是_____;
(5)若反应过程中产生的气体收集起来,可得到氢气的质量为多少g?_____