题目内容
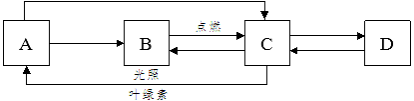
【题目】深圳市沿海城市,开发海水资源前进广阔。海水中含有丰富的食盐和氯化镁,下图是海水晒盐并从海水资源获取某些重要化工原料的流程

(1)图中①是__________池,结晶池分离出来的母液属于NaCl的____(选填“饱和”或“不饱和”)溶液。
(2)步骤②中要除去粗盐中不溶性杂质,通常采用的操作方法______________。
(3)固体C的化学式____________;步骤④属于__________(吸热或放热)反应。步骤⑤发生的化学反应方程式_____________________。
(4)步骤⑥加入的试剂B的名称______________。
【答案】蒸发 饱和 溶解、过滤、蒸发 CaO 放热 Ca(OH)2 +MgCl2=CaCl2 +Mg(OH)2↓ 稀盐酸
【解析】
(1)氯化钠的溶解度受温度影响变化不大,可用蒸发结晶的方法进行分离,所以图中①是蒸发池;结晶池分离出来的母液属于NaCl的饱和溶液;故填:蒸发;饱和;
(2)步骤②中要除去粗盐中不溶性杂质,通常采用的操作方法溶解、过滤、蒸发结晶;故填:溶解、过滤、蒸发结晶;
(3)石灰石的主要成分是碳酸钙,高温煅烧碳酸钙生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,此反应会放出大量的热,C是氧化钙;反应⑤是氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀;故填:CaO;放热;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
(4)步骤⑥是将氢氧化镁转化为氯化镁,所以加入的是盐酸;故填:盐酸。

 每日10分钟口算心算速算天天练系列答案
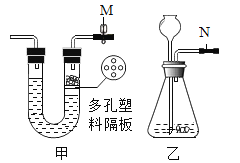
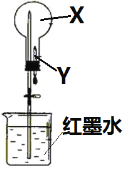
每日10分钟口算心算速算天天练系列答案【题目】学习了在过氧化氢分解制氧气的反应中二氧化锰的作用后,石建和秦思发现红砖粉末(主要含有氧化铁)也会对过氧化氢分解制氧气产生影响。
(提出问题)红砖粉末在过氧化氢分解制氧气的反应中起什么作用呢?
(猜想与假设)石建的猜想:红砖粉末在过氧化氢分解制氧气的反应中不起催化作用;
秦思的猜想:(1)____________。
(实验探究)..为验证猜想,进行下列实验活动。
实验序号 | (实验过程) | (收集证据) | (解释与结论) |
I | 实验前称量红砖粉末的质量 | 质量为mg | |
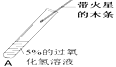
II |
| 伸入A中的带火星的木条不能复燃 | 是因为 (2)_____________ |
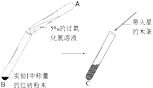
III | 将I称量的红砖粉末放入B中,
| 观察到C中的(3)_____ 。 | 用符号表达式解释C的 液体中产生现象的原因是(4)____________________。 与II对比,证明红砖粉末 (5)_________ 。 |
IV | 待试管C中没有现象时,重新加入过氧化氢溶液,伸入带火星的木条。重复此操作 | 均观察到与III中相同的实验现象 | 证明化学反应前后红砖粉末的(6)_______ 。 |
V | 反复实验后,经过相应的操作,再次称量红砖粉末的质量 | 质量为mg | 证明化学反应前后红砖粉末的(7)___________。 |
(总结与反思)综合上述实验结论,可确定(8)_________的猜想正确。实验室中用过氧化氢制氧气时使用二氧化锰而不是红砖粉末,由此你得出的一条结论或提出的一个有探究价值的问题是(9)___________。
【题目】化学兴趣小组的同学发现实验台上一瓶标签破损的无色溶液(标签如图).经了解得知该无色溶液原存放在盐溶液的柜子里,由此猜测可能是_____,
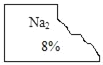
他们提出可能是碳酸钠、碳酸氢钠、硫酸钠 氯化钠、硝酸钠溶液中的一种,于是决定对这瓶溶液进行实验探究。
(理论分析)为了确定该溶液,他首先进行了分析,小组同学根据标签残留部分认为一定不是_____,他们的依据是_____。
(查阅资料)
Na2CO3+HCl=NaCl+NaHCO3 Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑ Na2CO3+BaCl2=BaCO3↓+2NaCl
(活动探究)
为确定其成分,小新同学设计如下方案进行探究(探究1)
实验步骤 | 现象 | 结论 |
该溶液少许于试管中,滴加过量的BaCl2溶液,振荡 | ①_____ | 则该溶液是Na2SO4溶液 |
过滤,向滤渣滴加稀盐酸 | ②_____ |
(2)小芳认为可以设计更简单的实验方案(探究2)
实验步骤 | 现象 | 结论 |
取该无色溶液少许于试管中,慢慢滴加少量的盐酸 | 没有气泡产生 | 溶液中没有碳酸钠,则该溶液是Na2SO4溶液 |
(解释)你认为上面两位同学对实验结果判定是否正确?请说明理由_____。
(实验反思)在区别判断物质成分时,除考虑物质本身的性质外,还需考虑_____。