题目内容
【题目】据统计,我国每年报废的手机超过 1 亿部,若不进行有效回收利用, 会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。

【提出问题】从废旧手机中可以回收到哪些有价值的金属?如何回收?
【查阅资料】
ⅰ.手机电路板中的金属及其价格如下表所示:
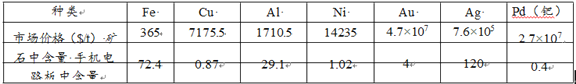
说明:Fe、Cu、Al、Ni 的含量用质量分数(%)表示,Au、Ag、Pd 的含量的单位为“g/t”。
ⅱ.Ni 的金属活动性位于氢前,Pd 的金属活动性位于氢后,NiCl2 溶液为绿色。
ⅲ.2Cu+O2+2H2SO4![]() CuSO4+2H2O
CuSO4+2H2O
【实验方案】
第一步:选择值得回收的金属。
依据资料ⅰ中的数据,废旧手机中有回收价值的金属有 Au、Ag、Cu 、Pd,原因是:①它 们市场价格较高;②_______________。
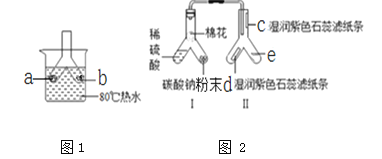
第二步:设计实验分离、回收部分金属。⑴___________,⑵_________。
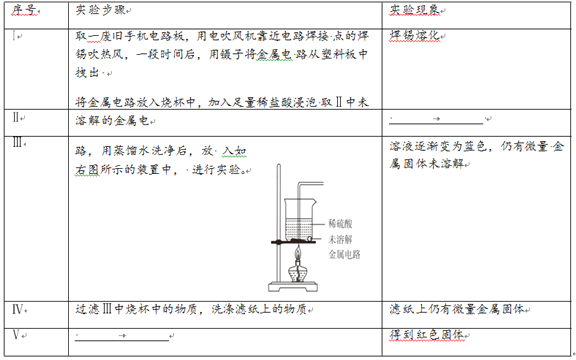 【问题讨论】
【问题讨论】
(1)由步骤Ⅰ中的现象,可推知焊锡的物理性质是________。
(2)步骤Ⅱ对应的实验现象是____________。
(3)步骤Ⅱ所得的溶液中,一定含有的金属元素是________。
(4)步骤Ⅴ的操作是__________。
【反思交流】
为了确认步骤Ⅳ中滤纸上的金属成分,应进一步查阅的资料为___________________。
【答案】 Au、Ag、Cu、Pd 在手机电路板中的含量高于其在矿石中的含量 溶液呈绿色 过滤 熔点低 产生气泡,溶液由无色变成绿色 Fe、Ni、Al 向得到的滤液中加入适量铁,充分反应后过滤 Au、Ag、Pd 在加热条件下,能否与氧气、稀硫酸发生反应
【解析】从废旧手机中回收金属。【提出问题】从废旧手机中可以回收到哪些有价值的金属?如何回收?【查阅资料】【实验方案】第一步:选择值得回收的金属。废旧手机中有回收价值的金属有 Au、Ag、Cu 、Pd,原因是:①它 们市场价格较高;②在手机电路板中的含量高于其在矿石中的含量。第二步:设计实验分离、回收部分金属。⑴实验现象∶溶液呈绿色,Ni的金属活动性位于氢前,与盐酸反应生成NiCl2 , NiCl2溶液为绿色;⑵实验步骤是过滤。【问题讨论】(1)焊锡的物理性质是熔点低,吹风机吹就可使其熔化。(2)步骤Ⅱ对应的实验现象是.产生气泡,溶液由无色变成绿色,Ni的金属活动性位于氢前,与盐酸反应生成NiCl2 和氢气, NiCl2溶液为绿色。(3)步骤Ⅱ所得的溶液中,一定含有的金属元素是. Fe、Ni、Al,他们位于氢前面,可以与盐酸反应生成可溶性物质。(4)步骤Ⅴ的操作是向得到的滤液中加入适量铁,充分反应后过滤。【反思交流】确认步骤Ⅳ中滤纸上的金属成分,应进一步查阅的资料为Au、Ag、Pd 在加热条件下,能否与氧气、稀硫酸发生反应。
点睛∶Ni的金属活动性位于氢前,与盐酸反应生成NiCl2 和氢气, NiCl2溶液为绿色。

 名校课堂系列答案
名校课堂系列答案【题目】下列图像不能正确反映对应变化关系的是
|
|
|
|
A.将水通电电解一 段时间 | B.加热一定量的高 锰酸钾固体 | C.向两份相等质量的块状大理石和粉末状大理石中分别加入过量的等浓度的稀盐酸 | D.向一定量的二氧化锰中加入过氧化氢溶液 |
A. A B. B C. C D. D