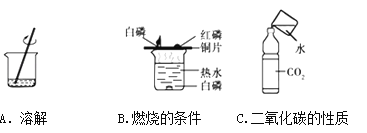
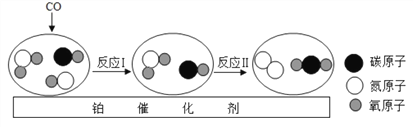
题目内容
【题目】A、B、D、E、F、G、M是初中常见物质,分别由C、H、O中的一种或两种元素组成,M为天然气的主要成分完全燃烧生成A和D,A能使澄清石灰水变浑浊,E、G为单质.它们之间关系如图所示,图中“→”并表示由某一物质可生成另一物质。
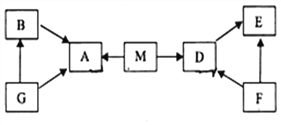
(1)G的化学式是______.
(2)F的化学式:_______.
(3)A使澄清石灰水变浑浊的化学方程式:_________________________
(4)M燃烧的化学方程式:_____________________.
【答案】 C H2O2 CO2+Ca(OH)2=CaCO3↓+H2O CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
【解析】M为天然气的主要成分,则M是甲烷(CH4)。甲烷燃烧生成A和D(二氧化碳和水),A能使澄清石灰水变浑浊,则A是二氧化碳(CO2),D是水(H2O)。E、G为单质,G会转化为二氧化碳,G转化的B也转化为二氧化碳,所以G是碳(C),B是一氧化碳(CO)。F能转化为D和E,D是水,E是单质,故F是过氧化氢(H2O2)溶液,E是氧气(O2)。(1)G的化学式是C;(2)F的化学式是H2O2;(3) CO2使澄清石灰水变浑浊的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;(4)甲烷燃烧的化学方程式为CH4+2O2点燃2H2O+CO2。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】以下是两个常见的工业流程,

流程一:从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,生产流程如下:
(1)加入过量的A物质,该A物质为______。操作a的名称是 _______,操作a所用到的玻璃仪器有烧杯、玻璃棒、_________,操作a中玻璃棒的作用是 _______ 。
(2)写出流程图中的固体成分的化学式 ____ ,B的溶液中溶质的化学式 _______
流程二:如图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略),请回答下列问题:
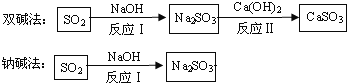
(1)CaSO3中Ca、S、O元素的质量比是_______。
(2)已知原料NaOH的价格为2.9元/kg. 而Ca(OH)2的价格为0.36元/kg.两种工艺中,处理相同质量的SO2,双碱法所需的原料成本更低,其原因是______________。
【答案】 铁 过滤 漏斗 引流 Fe和Cu H2SO4 5:4 : 6 双碱法中通过反应II实现了NaOH的循环利用,减少了NaOH的用量 处理等量SO2,氢氧化钙用量更少且价格便宜,所以双碱法成本更低
【解析】流程一:只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,所所加试剂是过量的铁,反应方程式为Fe+CuSO4==FeSO4+Cu ,反应后得到是固体铜和铁,溶液硫酸亚铁溶液,过滤可将难溶固体与液体分离,所以应过滤,过滤用到的仪器有:烧杯、漏斗、玻璃棒、铁架台,其中,玻璃棒的作用是引流;将铜和铁的混合物中的铁除掉,得硫酸亚铁和铜,所以应加入的试剂B为稀硫酸,因为.Fe+H2SO4=FeSO4+H2↑,而铜和酸不反应;流程二:(1)化合物中元素的质量比=(相对原子质量×原子个数)之比,CaSO3中Ca、S、O元素的质量比是40:32:3×16= 5:4 : 6;(2)Na2SO3 + Ca(OH)2 = CaSO3↓+2NaOH , 2NaOH+ SO2 == Na2SO3+ H2O;因此用双碱法(氢氧化钙和氢氧化钠联合使用)实现了NaOH的循环利用,减少了NaOH的用量 处理等量SO2,氢氧化钙用量更少且价格便宜,所以双碱法成本更低。
【题型】流程题
【结束】
26
【题目】碱式碳酸镁密度小,是橡胶制品的优良填料。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
【探究一】碱式碳酸镁的制备
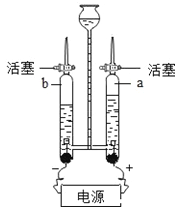
碱式碳酸镁可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的该复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如下图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始分解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120 ℃干燥得到碱式碳酸镁产品。
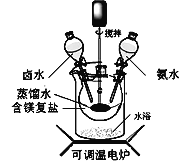
回答下列问题:
(1)搅拌的目的是________。
(2)设计实验检验碱式碳酸镁中含有Cl-
实验操作 | 实验现象 | 实验结论 |
①取样溶解,向样品溶液中滴加过量稀硝酸。 ②再向上述所得溶液加____溶液 | 现象①____; 现象②____; | 含有 Cl- |
【探究二】探究小组利用下图测定xMgCO3·yMg(OH)2·zH2O组成。已知:
(1)碱石灰的主要成分为氢氧化钠和生石灰,能吸收水蒸气和二氧化碳;
(2)碱式碳酸镁分解反应方程式为:xMgCO3·yMg(OH)2·zH2O === (x+y)MgO + xCO2↑+ (y+z) H2O
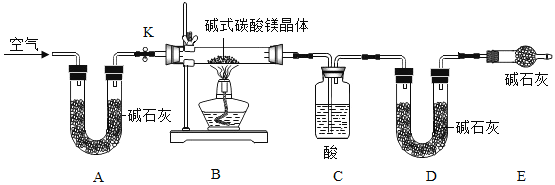
实验步骤:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:______(请补充该步操作内容)。
步骤5:称量相关装置的质量。
某同学在实验过程中采集了如下数据:
A.反应前玻璃管的质量100.0 g B.反应后玻璃管与残留固体总质量120.0 g
C.装置C实验后增重9.0 g D.装置D实验后增重17.6 g
回答下列问题:
(1)检查整套实验装置气密性:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中,打开活塞K,对装置B用酒精灯微热,若观察到____,则气密性良好;
(2)装置A的作用是____,如果没有装置A,则测定得到xMgCO3·yMg(OH)2·zH2O中的z值____(填“偏大”、“偏小”、“无影响”),装置C中的酸为___(写名称);
(3)根据实验测定的数据,求出碱式碳酸铜(xMgCO3·yMg(OH)2·zH2O)中x∶y∶z的最简整数比是_(要求写出过程)。