题目内容
【题目】图1中为X、Y两种固体物质的溶解度曲线。图2中两个烧杯中分别盛装X、Y的饱和溶液,两支试管中分别装有NaOH、NH4NO3固体,向两支试管中分别滴加适量水,现象如图2所示。下列说法正确的是
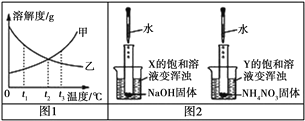
A. X的溶解度曲线为甲曲线
B. 降温可使Y的溶解度增大
C. X的饱和溶液从t2℃降温到t1℃,溶质的质量分数变大
D. t3℃时,X、Y的饱和溶液质量相等,则X的饱和溶液中溶剂的质量更多
【答案】D
【解析】氢氧化钠固体溶解放热,会导致溶液的温度升高,由图2现象可知X的溶解度随温度的升高而减小,即X为乙曲线;硝酸铵溶解温度降低,由现象可知Y的溶解度随温度的减小而减小,即Y为甲曲线。A、X为乙曲线,错误;B、降温可使Y的溶解度变小,错误;B、X的饱和溶液从t2℃降温到t1℃,溶质的质量分数变小,错误;D、t3℃时,X的溶解度小于Y的溶解度,即若X、Y的饱和溶液质量相等,则X的饱和溶液中溶剂的质量更多,正确。故选D。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目