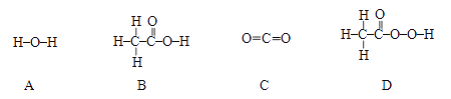题目内容
【题目】金属材料包括纯金属以及它们的合金。
(1)铁锅、铝锅和铜火锅可以用来炒菜、做饭和涮肉,是因为铁、铝、铜能够________。
(2)为了验证铁、铝、铜的金属活动性顺序,某同学选择了打磨过的铁丝,他还需要选择的两种盐溶液是__________________。写出实验中发生反应的化学方程式:_____________________。
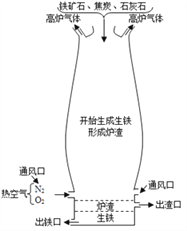
(3)炼铁的原理是利用一氧化碳与氧化铁的反应,化学方程式为______________________,该反应中氧化铁表现出______________(填“氧化性”或“还原性”)。如图是炼铁高炉示意图,写出原料焦炭的一个作用:_________________________。
(4)5g某钢样在纯氧中完全燃烧,得到0.33g二氧化碳。求此钢样中碳的质量分数______。(写出计算过程)
【答案】 导热 硫酸铝溶液、硫酸铜溶液(合理答案均可) Fe+CuSO4=Cu+FeSO4(合理答案均可) Fe2O3+3CO![]() 2Fe+3CO2 氧化性 反应生成炼铁所需的还原剂CO(或燃烧提供炼铁所需的高温) 1.8%
2Fe+3CO2 氧化性 反应生成炼铁所需的还原剂CO(或燃烧提供炼铁所需的高温) 1.8%
【解析】(1)铁、铝、铜能够导热,可用作铁锅、铝锅和铜火锅;(2)铁与硫酸铝溶液不反应,说明铁不如铝活泼,铁与硫酸铜溶液反应生成红色固体,说明铁比铜活泼,反应的化学方程式:Fe+CuSO4=Cu+FeSO4;(3)炼铁的原理是利用一氧化碳与氧化铁的反应,化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;该反应中氧化铁失去氧,具有氧化性;焦炭作用是:反应生成炼铁所需的还原剂CO(或燃烧提供炼铁所需的高温);(4)设钢样中碳的质量为x,则:
2Fe+3CO2;该反应中氧化铁失去氧,具有氧化性;焦炭作用是:反应生成炼铁所需的还原剂CO(或燃烧提供炼铁所需的高温);(4)设钢样中碳的质量为x,则:
O2+C![]() CO2
CO2
12 44
x 0.33g
![]()
x=0.09g
此钢样中碳的质量分数=![]() 100%=1.8%。
100%=1.8%。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
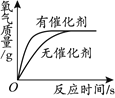
名牌学校分层周周测系列答案【题目】下列图像不能正确反映其变化过程的是
|
|
|
|
A. 加热一定质量的高锰酸钾固体 | B. 向一定质量的氢氧化钠溶液中加入稀盐酸至过量 | C.浓硫酸长期露置在空气中 | D. 用两份等质量、等质量分数的过氧化氢溶液制取氧气 |
A. A B. B C. C D. D
【题目】化学在日常生活中有广泛应用
(1)根据如图衣服标签的部分说明回答下列问题:

①面料中的棉属于_______(填“天然”或“合成”,下同)有机高分子材料,面料中的涤纶属于________有机高分子材料,
②你知道聚酯纤维有下列哪三个优点____________(填序号)
A. 强度高、弹性好 B. 耐磨
C. 吸水性、透气性好 D. 耐化学腐蚀
(2)均衡的膳食结构可以保障身体健康。某种食品的配料标签如图所示:
该配料中富含蛋白质的物质是____________。从营养均衡的角度看,该食品中除水外,还缺少的营养素是____________。
(3)以下是我们日常生活中常用的清洗剂,其名称及有效成分如下表:
生活中的 用品 |
|
活氧彩漂 |
污渍爆炸盐 |
有效成分 | 盐酸 | 过氧化氢 | 过碳酸钠 |
①清除以下物质,可以使用洁厕灵的是____________(填字母序号)。
A. 铁锈 B. 水垢(主要成分为碳酸钙和氢氧化镁) C. 油渍
②“活氧彩漂”可用于漂洗衣物、杀菌消毒等,原因是其有效成分过氧化氢分子中含有“过氧基”(—O—O—)。据此推测,下列物质中,可用作杀菌消毒剂的是____________(填序号)。