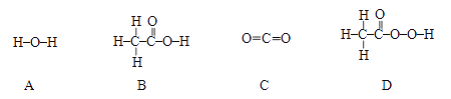��Ŀ����
����Ŀ��ij��ѧ��ȤС��ͨ��̽���ѧϰ�����⻯ѧ֪ʶ������һ���о�ѧϰ�����ش��й����⡣

�о����⣺ˮ��Һ�и��ֽⷴӦ��ʵ��
�����Ϣ�����絼�ʴ��������ڲ�����Һ�ĵ�����ǿ�����ܷ�ӳ����Ũ�ȴ�С��
������ͬ�¶���ͬ����Һ�絼��Խ������Ũ��Խ��
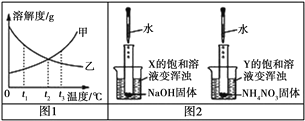
��1��ʵ��һ�����������£���һ�����һ��Ũ�ȵ�ϡBa��OH��2��Һ�еμ�2��3����ɫ��̪��Һ������絼�ʴ�������Ȼ��μ�ϡ���ᣬ�����Һ�ĵ絼�ʱ仯��ͼ�м�������ʾ��
��д��Ba��OH��2��H2SO4��Ӧ�Ļ�ѧ����ʽ________________________��
��M��ʱ�絼��Ϊ�㣬����Ũ��Ҳ����Ϊ�㣬��ʱ���Һ�徲�ú��______ɫ��
��ͨ���Լ����ߵķ���������˵���������_____������ţ���
A.M��ǰ�����»��Ĺ����У�H+��OH����ϳ�H2O��Ba2+��SO42����ϳ�BaSO4
B.M�����Һ�絼��������������Һ��H+��������
��2��ʵ��������������£������ͬŨ�ȵ�ϡBa��OH��2��Һ�еμ�2��3����ɫ��̪��Һ������絼�ʴ�������Ȼ��μ�ϡNa2SO4��Һ�������Һ�ĵ絼�ʱ仯����ͼ��������ʾ��
��ͨ���������ߵķ���������˵����ȷ����________������ţ���
A.ʵ�ʲμӷ�Ӧ����Ba2+��SO42����ϳ���BaSO4��Na+��OH��������������ʽ��������Һ��
B.��Һ��ɫֻ���dz����������ȥ
��N��ʱ����Һ�д������е�������__________________�������ӷ��ţ�����д���֣���
��ͨ���ȽϷ����������ѧ֪ʶ��֪����Һ�и��ֽⷴӦ��ʵ���Dz��뷴Ӧ�����ӣ���������˳����������ˮ��������Ũ��_______�������С������
��ע�⣺����Ե�(3)С�⽱��4�֣���ѧ�Ծ��ֲܷ�����60�֡���
��3����չ���������ʾ����д���ӷ���ʽ��ʾ��AgNO3+NaCl=AgCl��+NaNO3���ӷ���ʽ��Ag++Cl��=AgCl��
��д��BaCl2+Na2SO4=BaSO4��+2NaCl���ӷ���ʽ��________________________________��
����һ�������ͳ���ʯ��ˮ�г���ͨ�������CO2���壬��Һ�ȱ���Ǻ��������ʧ�����Ʋ�˹��̵���Һ��Ca2+��Ũ�ȱ仯���_____________________��
���𰸡� Ba��OH��2+H2SO4=BaSO4��+2H2O �� B AB Na+��OH����SO42�� ��С Ba2++SO42��=BaSO4�� �ȼ�С������
�����������⿼���˸��ֽⷴӦ��������ʵ�ʡ�
��1�����������������ᷴӦ�������ᱵ������ˮ����Ӧ�Ļ�ѧ����ʽΪBa(OH)2+H2SO4=BaSO4��+2H2O��
�ڼ�����M��ʱ����ǡ����ȫ��Ӧ����Һ�����ԣ���̪Ϊ��ɫ�����Һ�����ɫ��
��A��M��ǰ�����»��Ĺ����У��������������ᷴӦ�������ᱵ������ˮ��H+��OH����ϳ�H2O��Ba2+��SO42����ϳ�BaSO4����ȷ��B��M�����Һ�絼����������������Һ��H+�����������������Ҳ��������ѡB��
��2����A�����������������Ʒ�Ӧ�����������ƺ����ᱵ��ʵ�ʲμӷ�Ӧ����Ba2+��SO42����ϳ���BaSO4��Na+��OH��������������ʽ��������Һ�У���ȷ��B����Һ�д������������ӣ�����������Һ�ļ��룬������Ũ�ȵĽ��ͣ���Һ�ļ��Լ�������Һ��ɫֻ���dz����������ȥ����ȷ����ѡAB��
��N��ʱ����Һ�к����������ƺ����������ƣ����е������������ӡ����������Ӻ���������ӣ����ŷֱ��ǣ�Na+��OH����SO42����
����Һ�и��ֽⷴӦ��ʵ���Dz��뷴Ӧ�����ӣ���������˳����������ˮ��������Ũ�ȼ�С��
��3����BaCl2+Na2SO4=BaSO4��+2NaCl��Ӧ��ʵ���DZ����Ӻ���������ӽ�ϲ������ᱵ�����������ӷ���ʽΪBa2++SO42��=BaSO4����
����һ�������ͳ���ʯ��ˮ�г���ͨ�������CO2���壬��Һ�ȱ���ǣ�������̼��Ƴ������˹����и�����Ũ����С����������ʧ�Ĺ����������˿��ܵ�̼����ƣ������ӵ�Ũ���������̵���Һ��Ca2+��Ũ�ȱ仯������ȼ�С������

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����ѧ���ճ��������й㷺Ӧ��
��1��������ͼ�·���ǩ�IJ���˵���ش��������⣺

�������е�������_______�����Ȼ���ϳɡ�����ͬ���л��߷��Ӳ��ϣ������еĵ�������________�л��߷��Ӳ��ϣ�
����֪��������ά�������������ŵ�____________������ţ�
A. ǿ�ȸߡ����Ժ� B. ��ĥ
C. ��ˮ�ԡ����Ժ� D. �ͻ�ѧ��ʴ
��2���������ʳ�ṹ���Ա������彡����ij��ʳƷ�����ϱ�ǩ��ͼ��ʾ��
�������и��������ʵ�������____________����Ӫ������ĽǶȿ�����ʳƷ�г�ˮ�⣬��ȱ�ٵ�Ӫ������____________��
��3�������������ճ������г��õ���ϴ���������Ƽ���Ч�ɷ����±���
�����е� ��Ʒ |
|
������Ư |
���ձ�ը�� |
��Ч�ɷ� | ���� | �������� | ��̼���� |
������������ʣ�����ʹ�ý�������____________������ĸ��ţ���
A. ���� B. ˮ������Ҫ�ɷ�Ϊ̼��ƺ�������þ�� C. ����
�ڡ�������Ư��������Ưϴ���ɱ�������ȣ�ԭ��������Ч�ɷֹ�����������к��С�������������O��O�������ݴ��Ʋ⣬���������У�������ɱ������������____________������ţ���