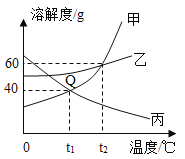
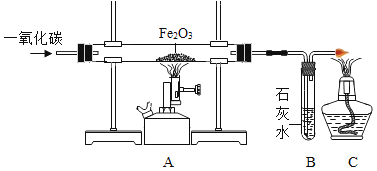
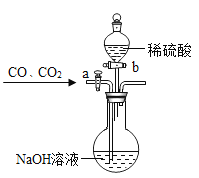
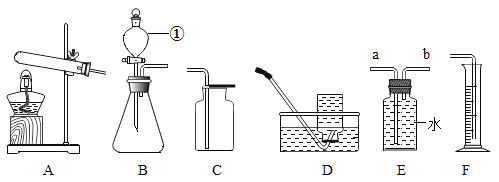
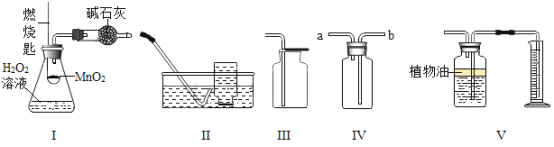
题目内容
【题目】现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.
(查阅资料)(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气.
(2)相对原子质量:Mg﹣24、Fe﹣56、Zn﹣65
(实验步骤及数据)取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量/g | 35.O | 35.0 | 35.O | 35.O |
剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
【答案】该混合物粉末中铜的质量分数是52.5%;该混合物粉末中另一金属为金属镁;第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是16.6%.
【解析】
试题(1)混合物中Cu的质量分数=![]()
(2)设该金属M的相对原子质量为X,第4次反应的稀硫酸质量为![]()
反应的总稀硫酸质量是35g×3+![]() =
=![]()
M+H2SO4═MSO4+H2↑
X 98
8g﹣4.2g![]() ×14%
×14%
X:98=3.8g:![]() ×14%
×14%
X=24
所以该金属是镁.
(3)设所得溶液中MgSO4的质量为y,生成H2的质量为z
Mg+H2SO4 ═MgSO4+H2↑
98 120 2
105g×14% y z
98:120═105g×14%:y y=18g
98:2═105g×14%:z z=0.3g
MgSO4溶液的质量分数为18g/(105g+3.6g﹣0.3g)×100%≈16.6%
答:该混合物粉末中铜的质量分数是52.5%;该混合物粉末中另一金属为金属镁;第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是16.6%.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案【题目】如图所示,某兴趣小组的同学为了探究酸碱盐之间能否发生反应做了以下几组实验。回答下列问题:
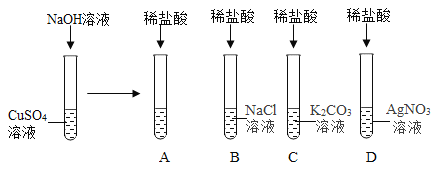
(1)向硫酸铜溶液中滴入氢氧化钠溶液,观察到的现象为_____,该反应的化学方程式为_____,继续滴加稀盐酸,通过稀盐酸与_____反应的现象证明了酸能与碱发生反应。
(2)B试管中无明显现象,不能发生复分解反应,理由是_____。
(3)观察到C试管中有_____生成,于是得出结论:稀盐酸能与碳酸钾发生反应。
(4)在D试管中有白色沉淀生成,于是得出结论:稀盐酸能与硝酸银发生反应。反应的化学方程式为_____。
(5)同学们对反应后C试管中溶液的溶质成分进行分析,得出以下结论
结论一:KCl
结论二:KCl、HCl;
结论三:_____。
某同学通过以下两种方法验证结论二是正确的。
实验操作 | 实验现象 | 实验结论 |
方法一:取C中溶液少许,加入足量的AgNO3溶液 | 产生白色沉淀 | 结论二正确 |
方法二:取C中溶液少许,加入适量的_____。 | 溶液颜色变红 |
(6)有些同学对方法一提出质疑,认为方法一不正确,理由是_____。当我们对反应后所得溶液的溶质成分进行猜想时,除了考虑生成物外,还要考虑_____。
【题目】如图是元素周期表的一部分,请回答:
H | |||||||
① | F | ||||||
Na | ② | Si | ③ | ④ | |||
(1)某原子的原子结构示意为: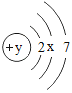 。图中 y=_____;该原子在化学反应中易____(填“得到”或“失去”)电子,形成离子的符号为_____;
。图中 y=_____;该原子在化学反应中易____(填“得到”或“失去”)电子,形成离子的符号为_____;
(2)③与④两种元素最本质的区别是它们原子中的_____不同;
(3)①处的元素与②处的元素形成化合物的化学式为_____。