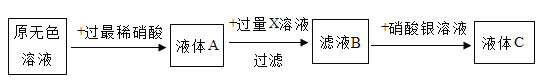
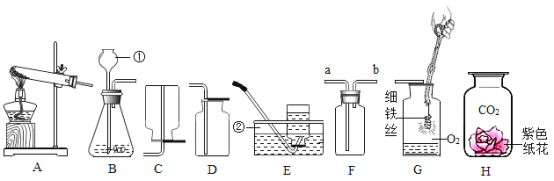
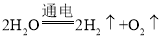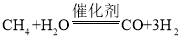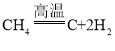题目内容
【题目】如图是元素周期表的一部分,请回答:
H | |||||||
① | F | ||||||
Na | ② | Si | ③ | ④ | |||
(1)某原子的原子结构示意为: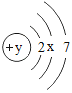 。图中 y=_____;该原子在化学反应中易____(填“得到”或“失去”)电子,形成离子的符号为_____;
。图中 y=_____;该原子在化学反应中易____(填“得到”或“失去”)电子,形成离子的符号为_____;
(2)③与④两种元素最本质的区别是它们原子中的_____不同;
(3)①处的元素与②处的元素形成化合物的化学式为_____。
【答案】17 得到 Cl- 质子数(或核电荷数) MgO
【解析】
(1)在原子中,质子数=核外电子数,所以x为8,y=2+8+7=17;其最外层有7个电子,在化学反应中易得到1个电子形成带有1个单位负电荷的氯离子--Cl-;
(2)元素是具有相同核电荷数(即核内质子数)的一类原子的总称,决定元素的种类得是核电荷数(即核内质子数),③与④两种元素最本质的区别是原子的质子数(或核电荷数)不同;
(3)根据元素在元素周期表中的位置可知,①是氧元素,在化合物中显-2价,②是镁元素,在化合物中显+2价,二者组成的化合物氧化镁的化学式为MgO。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.
(查阅资料)(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气.
(2)相对原子质量:Mg﹣24、Fe﹣56、Zn﹣65
(实验步骤及数据)取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量/g | 35.O | 35.0 | 35.O | 35.O |
剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
【题目】在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9