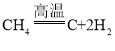题目内容
【题目】实验室中用CO还原磁铁矿(主要成分为Fe3O4)得到铁,设计的实验装置如下;
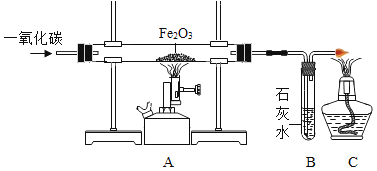
(1)开始实验时,A装置中首先要进行的操作是 _____________(填“加热”或“通一氧化碳”)
(2)CO还原Fe3O4的化学方程式为______________________ 。
(3)B装置的作用是______________________。
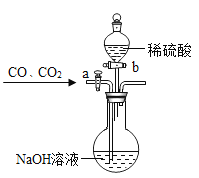
(4)为分离A装置中反应排出的一氧化碳和二氧化碳,某同学设计了如下装置(固定装置已略去,a、b为活塞):当关闭活塞b,打开活塞a时,可分离得到_____________,然后关闭活塞a,再打开活塞b,又可分离得到。
【答案】通一氧化碳 Fe3O4+4CO![]() 3Fe+4CO2 检验是否有二氧化碳气体生成 CO ,CO2
3Fe+4CO2 检验是否有二氧化碳气体生成 CO ,CO2
【解析】
(1)开始实验时,A装置中首先要进行的操作是通一氧化碳,排出装置中的空气,以免加热发生爆炸。
(2)CO还原Fe3O4生成铁和二氧化碳。
(3)B装置用石灰水检验二氧化碳气体。
(4)当关闭活塞b,打开活塞a时,二氧化碳被氢氧化钠溶液吸收生成碳酸钠和水,可分离得到一氧化碳,然后关闭活塞a,再打开活塞b,稀硫酸和碳酸钠反应生成二氧化碳。
(1)开始实验时,A装置中首先要进行的操作是通一氧化碳,排出装置中的空气,以免加热发生爆炸。
(2)CO还原Fe3O4生成铁和二氧化碳,化学方程式为Fe3O4+4CO![]() 3Fe+4CO2。
3Fe+4CO2。
(3)B装置用石灰水检验二氧化碳气体,的作用是检验是否有二氧化碳气体生成。
(4)当关闭活塞b,打开活塞a时,二氧化碳被氢氧化钠溶液吸收生成碳酸钠和水,可分离得到一氧化碳;然后关闭活塞a,再打开活塞b,稀硫酸和碳酸钠反应生成二氧化碳,又可分离得到二氧化碳。

 阅读快车系列答案
阅读快车系列答案【题目】现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.
(查阅资料)(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气.
(2)相对原子质量:Mg﹣24、Fe﹣56、Zn﹣65
(实验步骤及数据)取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量/g | 35.O | 35.0 | 35.O | 35.O |
剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?