题目内容
【题目】某学习小组在验证“氢氧化钙溶液导电性”的实验时,发现除了两根石墨电极表面分别产生氢气、氧气外,还出现了一个意外现象:容器内的澄清石灰水变浑浊。
(提出问题)是什么原因导致澄清石灰水变浑浊?
(猜想与假设)他们分别对这种意外现象作如下猜想:
甲同学:________________。
乙同学:可能是电解过程中放热,温度升高使氢氧化钙固体析出;
丙同学:可能是石墨电极被通电时产生的活性氧氧化产生的CO2与石灰水反应产生了沉淀。
(设计实验)
(1)甲、乙、丙三位同学分别设计了如下实验。
实验步骤 | 实验现象 | 实验结论 |
甲:向装有10ml饱和澄清石灰水的烧杯中加入10ml蒸馏水,接通电源,计时3分钟 | a.两电极表面均产生气泡, 溶液体积几乎无变化; b. ___________________ | 甲同学猜想不正确 |
乙:__________________ | _______________________ | 乙同学猜想不正确 |
丙:将电解实验中产生的白色浑浊过滤,并向沉淀中加入足量的稀盐酸。 | _______________________ | 丙同学猜想正确 |
(2)产生白色浑浊的化学方程式为___________________________。
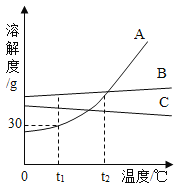
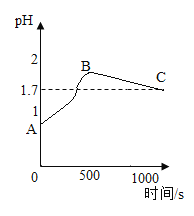
(3)丙同学实验后,为了防止废液中过量的盐酸污染环境,他按照传统方式向废液中加入过量的石灰石,并同时用pH传感器测整个过程的pH变化,即从开始反应到最终不再产生气体直至过量石灰石沉淀分层,静置一段时间后得到的图像如图所示。最终溶液pH为1.7,则C点时溶液中的溶质为______________(填化学式);AB段pH.上升的原因是________________;BC段变化的原因是_______;你对“在不同指示剂的情况下,用过量石灰石除去废液里的稀盐酸”这种方案的认识是___________________。
【答案】可能是电解过程中,溶剂减少,使Ca(OH)2固体析出 溶液依然出现浑浊 取适量的澄清石灰水加热一段时间 溶液依然澄清 沉淀逐渐溶解并产生大量气泡 ![]() HCl、CaCl2 盐酸与碳酸钙发生反应,酸性变弱,pH变大 水蒸气随二氧化碳气体逸出,剩余的酸浓度略变大,pH变小 过量的碳酸钙并不能将废液里盐酸反应完。(当盐酸浓度下降到一定值时,就不能再与石灰石反应)
HCl、CaCl2 盐酸与碳酸钙发生反应,酸性变弱,pH变大 水蒸气随二氧化碳气体逸出,剩余的酸浓度略变大,pH变小 过量的碳酸钙并不能将废液里盐酸反应完。(当盐酸浓度下降到一定值时,就不能再与石灰石反应)
【解析】
[猜想与假设]
可能是电解过程中,溶剂减少,使Ca(OH)2固体析出;溶液依然出现浑浊。
[设计实验]
(1)根据实验结论可推测实验现象和实验步骤,可填表如下:
实验步骤 | 实验现象 | 实验结论 |
甲:向装有10ml饱和澄清石灰水的烧杯中加入10ml蒸馏水,接通电源,计时3分钟 | a.两电极表面均产生气泡, 溶液体积几乎无变化; b. 溶液依然出现浑浊 | 甲同学猜想不正确 |
乙:取适量的澄清石灰水加热一段时间 | 溶液依然澄清 | 乙同学猜想不正确 |
丙:将电解实验中产生的白色浑浊过滤,并向沉淀中加入足量的稀盐酸。 | 沉淀逐渐溶解并产生大量气泡 | 丙同学猜想正确 |
(2)产生白色浑浊的化学反应是二氧化碳与石灰水发生反应,其化学方程式为![]() 。
。
(3)若最终溶液pH为1.7,则溶液显酸性,那么C点时溶液中的溶质为剩余的HCl和反应生成的CaCl2 ;AB段pH上升的原因是盐酸与碳酸钙发生反应,酸性变弱,溶液pH变大;BC段变化的原因是水蒸气随二氧化碳气体逸出,剩余的酸浓度略变大,pH变小;根据图示可知过量的碳酸钙并不能将废液里盐酸反应完,当盐酸浓度下降到一定值时,就不能再与石灰石反应,则用过量石灰石除去废液里的稀盐酸是不准确的。

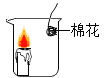
【题目】新年联欢晚会上,老师给同学们表演了一个魔术:大烧杯中盛有一只燃着的蜡烛和一团包有过氧化钠(Na2O2)的棉花,将一瓶二氧化碳倒入烧杯中,蜡烛慢慢的熄灭,然后棉花突然剧烈的燃烧起来。这出乎意料的现象引起了同学们的极大兴趣,请你参与同学们的讨论和探究。
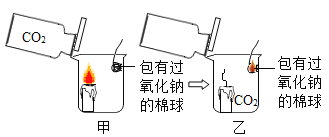
蜡烛熄灭的原因是_______________。
(提出问题)棉花为什么会燃烧?
(提出猜想)
(1)可能是蜡烛燃烧引燃了棉花。
(2)可能是二氧化碳与过氧化钠反应生成了氧气。
(3)_____________。
(实验验证)
序号 | 实验操作 | 主要实验现象 | 实验结论及解释 |
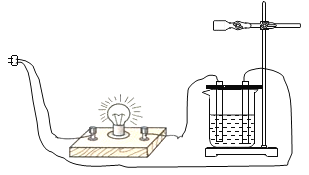
① | 按下图所示装置进行实验
| 无现象 | 猜想(1)____________(填“成立”或“不成立”) |
② | 向盛满二氧化碳的集气瓶中加入适量的过氧化钠粉末,充分振荡,并______________ | ________ | 二氧化碳与过氧化钠反应生成了氧气,猜想(2)成立 |
③ | _____________ | ______ | 猜想(3)成立 |
(实验结论)
(1)CO2与Na2O2反应生成了氧气与一种化合物,化学方程式为______________。
(2)通常CO2可作灭火剂,但有些物质(如Na2O2)着火,不能用CO2熄灭。
【题目】某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。
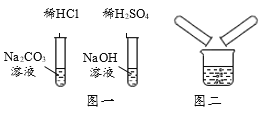
(查阅资料)Na2SO4溶液、NaCl溶液呈中性。
(提出猜想)猜想1:Na2SO4、NaCl;
猜想2:Na2SO4、NaCl和_____;
猜想3:Na2SO4、NaCl和H2SO4;
猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
(交流讨论)小强同学认为猜想4一定是错误的,他的理由是_____(用化学方程式表示)。
(进行实验)小明同学设计如下两个实验方案:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,加入几滴紫色石蕊溶液 | _____ | 猜想3正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,加入少量铁粉 | _____ |
请写出方案二中有关反应的化学方程式:_____。
(反思与总结)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。