题目内容
【题目】硬水不仅对人体健康有害,而且会给生活带来很多麻烦。硬水受热后会产生水垢,水垢的主要成分是碳酸钙和氢氧化镁。实验室用水垢制取纯净氯化钙固体的流程如下(假设水垢中的其他成分不参与反应),请回答下列问题:
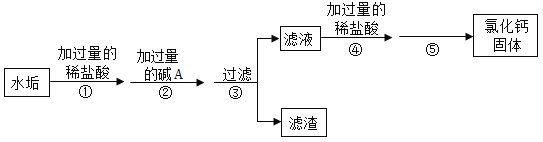
(1)生活中常用___________________区别硬水和软水。
(2)步骤②中生成沉淀的化学反应方程式是______________________。
(3)步骤④中加入过量稀盐酸的目的是______________________。
(4)步骤⑤是利用______________________的方法得到氯化钙固体。该操作中玻璃棒的作用是__________。
【答案】肥皂水 ![]() 将滤液中的氢氧化钙完全转化为氯化钙 蒸发结晶 搅拌,防止因局部温度过高,造成液体飞溅
将滤液中的氢氧化钙完全转化为氯化钙 蒸发结晶 搅拌,防止因局部温度过高,造成液体飞溅
【解析】
(1)生活中常用肥皂水来区分硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,故填:肥皂水;
(2)水垢的主要成分是碳酸钙和氢氧化镁,加入过量稀盐酸,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,氢氧化镁和稀盐酸反应生成氯化镁和水,由于该实验是制取纯净氯化钙固体,故应将氯化镁除去,可加入氢氧化钙,氢氧化钙与氯化镁反应生成氢氧化镁和氯化钙,该反应的化学方程式为:![]() ;
;
(3)由于步骤②中加入了过量的氢氧化钙,故步骤④中加过量的稀盐酸,氢氧化钙与稀盐酸反应生成氯化钙和水,将过量的氢氧化钙转化为氯化钙,故填:将滤液中的氢氧化钙完全转化为氯化钙;
(4)步骤⑤由液体得到固体,故该方法是蒸发结晶;
在蒸发过程中,玻璃棒的作用是:搅拌,防止局部温度过高,造成液滴飞溅。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】某学习小组在验证“氢氧化钙溶液导电性”的实验时,发现除了两根石墨电极表面分别产生氢气、氧气外,还出现了一个意外现象:容器内的澄清石灰水变浑浊。
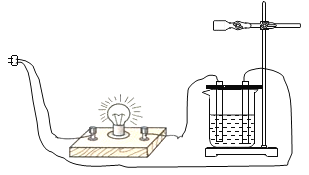
(提出问题)是什么原因导致澄清石灰水变浑浊?
(猜想与假设)他们分别对这种意外现象作如下猜想:
甲同学:________________。
乙同学:可能是电解过程中放热,温度升高使氢氧化钙固体析出;
丙同学:可能是石墨电极被通电时产生的活性氧氧化产生的CO2与石灰水反应产生了沉淀。
(设计实验)
(1)甲、乙、丙三位同学分别设计了如下实验。
实验步骤 | 实验现象 | 实验结论 |
甲:向装有10ml饱和澄清石灰水的烧杯中加入10ml蒸馏水,接通电源,计时3分钟 | a.两电极表面均产生气泡, 溶液体积几乎无变化; b. ___________________ | 甲同学猜想不正确 |
乙:__________________ | _______________________ | 乙同学猜想不正确 |
丙:将电解实验中产生的白色浑浊过滤,并向沉淀中加入足量的稀盐酸。 | _______________________ | 丙同学猜想正确 |
(2)产生白色浑浊的化学方程式为___________________________。
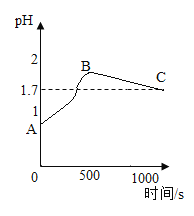
(3)丙同学实验后,为了防止废液中过量的盐酸污染环境,他按照传统方式向废液中加入过量的石灰石,并同时用pH传感器测整个过程的pH变化,即从开始反应到最终不再产生气体直至过量石灰石沉淀分层,静置一段时间后得到的图像如图所示。最终溶液pH为1.7,则C点时溶液中的溶质为______________(填化学式);AB段pH.上升的原因是________________;BC段变化的原因是_______;你对“在不同指示剂的情况下,用过量石灰石除去废液里的稀盐酸”这种方案的认识是___________________。