题目内容
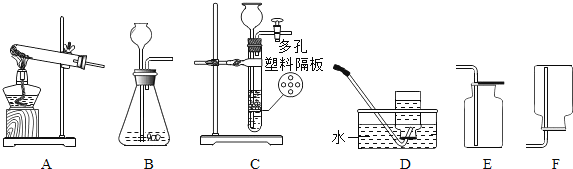
【题目】某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。
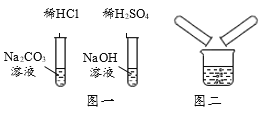
(查阅资料)Na2SO4溶液、NaCl溶液呈中性。
(提出猜想)猜想1:Na2SO4、NaCl;
猜想2:Na2SO4、NaCl和_____;
猜想3:Na2SO4、NaCl和H2SO4;
猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
(交流讨论)小强同学认为猜想4一定是错误的,他的理由是_____(用化学方程式表示)。
(进行实验)小明同学设计如下两个实验方案:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,加入几滴紫色石蕊溶液 | _____ | 猜想3正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,加入少量铁粉 | _____ |
请写出方案二中有关反应的化学方程式:_____。
(反思与总结)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。
【答案】Na2CO3 H2SO4+Na2CO3=Na2SO4+CO2↑+H2O 溶液变红 产生气泡,溶液由无色逐渐变成浅绿色 Fe+H2SO4=FeSO4+H2↑
【解析】
[提出猜想]
猜想1:盐酸和碳酸钠、稀硫酸和氢氧化钠都恰好完全反应:Na2SO4、NaCl;
猜想2:碳酸钠过量时:Na2SO4、NaCl和Na2CO3;
猜想3:稀硫酸过量时:Na2SO4、NaCl和H2SO4;
猜想4:Na2SO4、NaCl、H2SO4和Na2CO3故填:Na2CO3;
[交流讨论]
小强同学认为猜想4一定是错误的,理由是碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O故填:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O
[进行实验]
取少量烧杯中的溶液于洁净的试管中,加入几滴紫色石蕊溶液,溶液变红色,说明溶液中含有稀硫酸;取少量烧杯中的溶液于洁净的试管中,加入少量铁粉,产生气泡,溶液由无色变成浅绿色,是因为铁和稀硫酸反应生成硫酸亚铁和氢气,实验过程如下所示:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,加入几滴紫色石蕊溶液 | 溶液变红色 | 猜想3正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,加入少量铁粉 | 产生气泡,溶液由无色变成浅绿色 |
故填:溶液变红色;产生气泡,溶液由无色变成浅绿色
方案二中,铁和稀硫酸反应的化学方程式:Fe+H2SO4=FeSO4+H2↑;故填:Fe+H2SO4=FeSO4+H2↑

 走进文言文系列答案
走进文言文系列答案