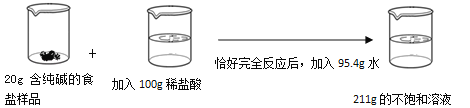
题目内容
【题目】为充分开发利用海洋资源,全面促进海洋经济持续健康发展,烟台市近日出台《2014年烟台市海洋经济发展意见》。请围绕“海洋”这个话题回答以下问题:
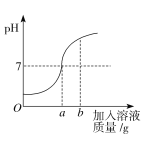
(1)从海水中提取出的粗盐中除了NaCl外,还含有Ca2+、Mg2+、SO42-及泥沙等杂质,为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。下列操作顺序中最合适的是 。
A.②④⑤①③ B.⑤④②③①
C.⑤②④③① D.②⑤④①③
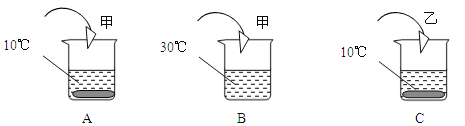
(2)海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁。
①工业上从母液中提取氯化镁的过程如下图:反应1的基本反应类型是 ;物质X是 (填名称)。

②海水制镁过程中对于如何富集镁离子,甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳
乙:高温加热蒸发海水后,加入石灰乳
丙:向晒盐后的卤水中,加入石灰乳
通过分析比较,你认为 的设想最为经济合理(选填“甲”、“乙”或“丙”).
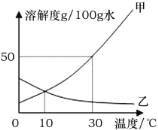
(3)我国化学家侯德榜在氨碱法的基础上创立的“侯氏制碱法”,是向滤出NaHCO3晶体后的NH4Cl溶液中加入NaCl粉末,析出可用作肥料的NH4Cl。NH4Cl和NaCl的溶解度曲线如图所示。
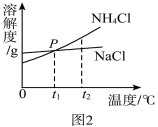
①写出一条P点表示的意义 。
②将t2℃时NH4Cl饱和溶液的温度降到t1℃,溶液中NH4Cl的质量分数会 (填“变大”“变小”“不变”之一)。
③当NH4Cl固体中含有少量NaCl时,可采用 (填“降温结晶”或“蒸发结晶”)的方法提纯NH4Cl。
【答案】(1)D (2)①复分解反应 盐酸 ②丙
(3)①t1℃时NH4Cl和NaCl的溶解度相等 ②变小 ③降温结晶
【解析】
试题分析:(1)步骤②加过量NaOH溶液是为了除去杂质离子Mg2+,步骤⑤加过量BaCl2溶液是为了除去杂质离子SO42-,步骤④加过量Na2CO3溶液是为了除去原杂质离子Ca2+以及过量的Ba2+,故步骤④一定个要在步骤⑤之后,③加适量盐酸为了除去所加的过量NaOH溶液和Na2CO3溶液,故从海水中提取出的粗盐中除了NaCl外,还含有Ca2+、Mg2+、SO42-及泥沙等杂质,为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,操作顺序中最合适的是D
(2)①工业上从母液中提取氯化镁的过程如下图:反应1的方程式为:MgCl2+Ca(OH)2==Mg(OH)2↓+CaCl2,故基本反应类型是复分解反应;要将Mg(OH)2转化为氯化镁,物质X是盐酸
②因为海水中氯化镁的浓度很稀,故甲:直接往海水中加入石灰乳,这样产生的Mg(OH)2并不多,乙:高温加热蒸发海水后,加入石灰乳需要浪费大量的能源,丙:向晒盐后的卤水中,加入石灰乳的设想最为经济合理
(3)①P点是NH4Cl和NaCl的溶解度曲线的交点,故P点表示的意义:t1℃时NH4Cl和NaCl的溶解度相等
②根据溶解度曲线,NH4Cl的溶解度随温度的升高而增大,故将t2℃时NH4Cl饱和溶液的温度降到t1℃,有晶体析出,故溶液中NH4Cl的质量分数会变小
③根据溶解度曲线,NH4Cl的溶解度随温度的升高变化的趋势比NaCl的溶解度随温度的升高变化的趋势要更大,故当NH4Cl固体中含有少量NaCl时,可采用降温结晶

 计算高手系列答案
计算高手系列答案