题目内容
【题目】(5分)下图所示是气体制取与性质验证的组合实验。打开A中分液漏斗活塞后,A、B、C、D、E中均可观察到明显现象。
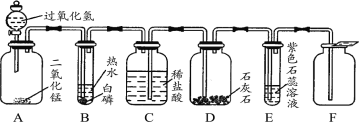
(1)A中发生反应的化学方程式为 。
(2)B中的现象是 。
(3)E中的现象 ,产生此现象的原因是 (用化学方程式表示)
(4)F装置收集的气体是 。
【答案】(1)2H2O2 MnO22H2O + O2↑ (2)产生大量白烟
(3)紫色石蕊试液变红 H2O+CO2=H2CO3 (4) CO2
【解析】
试题分析:(1)A中是将过氧化氢溶液加入到二氧化锰中,发生反应的化学方程式为:2H2O2 MnO22H2O + O2↑
(2)燃烧条件:(1)可燃物(2)氧气(或空气)(3)温度达到着火点(三者缺一不可,否则不能燃烧);B中白磷满足了上述三个条件,故现象是:白磷燃烧,产生大量白烟
(3)由于装置C中的盐酸被压入到装置D中,两者发生反应:CaCO3+2HCl==CaCl2+H2O+CO2↑,故E中的现象紫色石蕊试液变红,产生此现象的原因是二氧化碳能与水反应生成碳酸,酸能使紫色石蕊试液变红,化学方程式为:H2O+CO2=H2CO3
(4)F装置收集的气体是CO2

练习册系列答案
相关题目