题目内容
【题目】(8分)请根据如图所示的实验过程和提供的数据计算,
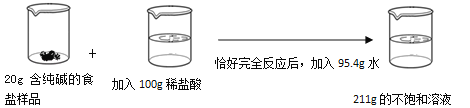
(1)生成气体的质量为 g;
(2)求该样品中氯化钠的质量分数。
(3)将所得不饱和溶液配置成15%的氯化钠溶液需要向溶液中加入氯化钠多少克?(精确到0.1g )
【答案】(1)4.4g (2)47% (3)12.4g
【解析】
试题分析:(1)根据质量守恒定律,生成气体的质量=20g+100g+95.4g-211g=4.4g
(2)根据化学方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑中CO2与Na2CO3、NaCl的质量关系,可分别计算出Na2CO3、NaCl的质量,进一步计算出该样品中氯化钠的质量分数
解:设Na2CO3的质量为x,生成的NaCl质量为y
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
106:44=x:4.4g x=10.6g
样品中氯化钠的质量分数=(20g-10.6g)/20g×100%=47%
117:44=y:4.4g y=11.7g
故所得氯化钠溶液的溶质质量分数=(20g-10.6g+11.7g)/211×100%=10%
(3)故可设加入氯化钠质量为z,抓住溶质的质量列等式为
20g-10.6g+11.7g +z=(211g+z) ×15%
Z=12.4g

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目