题目内容
【题目】用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如下图所示:
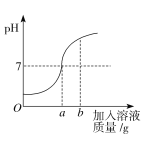
(1)该实验是将________________(选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)当加入溶液的质量为bg时,溶液中的溶质是________________________。
(3)当加入溶液的质量a为40 g时,求所得溶液中溶质的质量。
【答案】(1)氢氧化钠溶液 (2)NaCl和NaOH (3)5.85g
【解析】
试题分析:(1)图像起始点的pH小于7,反应中逐渐增大,说明是将氢氧化钠溶液滴加到盐酸中
(2)当加入溶液的质量为bg时,pH大于7,说明氢氧化钠过量,溶质为生成的NaCl和过量的NaOH
(3)由氢氧化钠溶液的质量和其溶质的质量分数可求出反应的氢氧化钠的质量,然后由方程式可计算出生成的氯化钠的质量
解:设所得溶液中溶质的质量为x
NaOH + HCl = NaCl + H2O
40 58.5
40g×10% x
40:58.5=(40g×10%):x
X=5.85g
答:所得溶液中溶质的质量为5.85g

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目