题目内容
【题目】某课外活动小组的同学为测定假黄金(铜锌合金)的组成,称取25克假黄金样品置于烧杯中,用稀硫酸80克分4次加入,实验数据记录如下.求:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
稀硫酸的质量/克 | 20 | 20 | 20 | 20 |
残留金属的质量/克 | 21.75 | 18.5 | 15.25 | 15.25 |
(1)假黄金与稀硫酸恰好完全反应是___________次;
(2)25克假黄金样品中锌的质量为______________克;
(3)四次实验产生气体的总质量是多少_________?(写出详细计算过程)
【答案】第一、二、三次 9.75 0.3
【解析】
根据金属的活动性可知,黄铜中铜不能与稀硫酸发生反应,而锌可与稀硫酸放出氢气;随锌与稀硫酸发生反应,剩余固体质量不断减少;由第1次实验数据,加入20g稀硫酸固体质量减少3.25g,说明20g稀硫酸完全反应可消耗3.25g锌;对比后面的实验数据可发现,第4次加入20g稀硫酸时,固体质量不变,可以说明此时黄铜中的锌已完全反应,则所剩余固体为不与稀硫酸反应的铜;根据反应的化学方程式,可由反应消耗锌的质量计算产生气体的质量;前三次反应中稀硫酸都完全反应,所以,第三次加入硫酸充分反应后所得溶液为硫酸锌溶液;根据反应的化学方程式,由消耗硫酸的质量计算生成物硫酸锌的质量与所得溶液的比即溶液中溶质的质量分数。
解:(1)由分析可知:第一、二、三次假黄金与稀硫酸恰好完全反应;
(2)根据质量守恒定律,锌的质量=25-15.25=9.75克;
(3)设锌与稀硫酸反应能生成氢气质量为x,
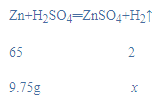
![]()
x=0.3g,
答:(1)第一、二、三次假黄金与稀硫酸恰好完全反应;
(2)25克假黄金样品中锌的质量为9.75克;
(3)四次实验产生气体的质量为0.3克。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】某化学兴趣小组在实验室用氯酸钾和二氧化锰混合加热制取氧气时,发现制得的气体有刺激性气味,于是在老师的指导下对该气体成分进行探究。
(提出问题)氯酸钾和二氧化锰混合加热后产生的气体成分是什么?
(查阅资料)![]() 氯酸钾和二氧化锰混合加热产生的气体只以单质形式存在;
氯酸钾和二氧化锰混合加热产生的气体只以单质形式存在;
![]() 氯气
氯气![]() 是有刺激性气味的气体,能溶于水,能使湿润的淀粉碘化钾试纸变蓝。
是有刺激性气味的气体,能溶于水,能使湿润的淀粉碘化钾试纸变蓝。
(猜想与假设)猜想一:该气体是![]() ;猜想二:该气体是
;猜想二:该气体是![]() ;猜想三:该气体是______
;猜想三:该气体是______
(实验探究)
序号 | 实验操作 | 实验现象 | 结论 |
| 小丽用排水法收集A、B两瓶气体,将带火星木条伸入A中;湿润的淀粉碘化钾试纸伸入B中。 | A中带火星木条复燃,B中淀粉碘化钾试纸不变色。 | 猜想 ______ 成立 |
| 小岚用向上排空气法收集C、D两瓶气体,将带火星木条伸入C中,湿润的淀粉碘化钾试纸伸入D中。 | C中带火星木条复燃,D中淀粉碘化钾试纸 ______ | 猜想三成立 |
(反思与评价)小涛认为小丽的结论不正确,原因是______
(拓展应用)![]() 氯酸钾和二氧化锰混合加热,当不再产生气体时的剩余固体是______、______
氯酸钾和二氧化锰混合加热,当不再产生气体时的剩余固体是______、______![]() 填化学式
填化学式![]() 。
。
![]() 二氧化锰不仅能作催化剂还可以做反应物。请完成该反应的化学方程式:
二氧化锰不仅能作催化剂还可以做反应物。请完成该反应的化学方程式:![]()
![]()
![]() ______
______![]() 。
。