题目内容
【题目】现有盐酸和氯化钙的混合溶液,向其中逐滴加入碳酸钠溶液,生成沉淀质量和加入碳酸钠溶液质量的变化关系如图。下列说法错误的是
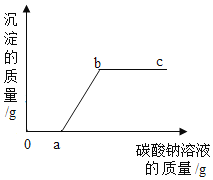
A.a点时,溶液中溶质质量比原混合溶液溶质质量大
B.b点时,溶液呈中性
C.c点时,溶液中有3种溶质
D.0~a段有气泡生成
【答案】C
【解析】
0~a段是碳酸钠和盐酸反应生成氯化钠、水、二氧化碳,a~b段是碳酸钠氯化钙反应生成碳酸钙和氯化钠。
A、a点时,碳酸钠恰好和盐酸反应生成氯化钠、水、二氧化碳,每73份质量的氯化氢和碳酸钠反应生成117份质量的氯化钠,溶液中溶质质量比原混合溶液溶质质量大,说法正确;
B、b点时,氯化钙和碳酸钠恰好完全反应,生成氯化钠溶液呈中性,说法正确;
C、c点时,溶液中有氯化钠和碳酸钠2种溶质,说法错误;
D、 0~a段是碳酸钠和盐酸反应生成氯化钠、水、二氧化碳,有气泡生成,说法正确。
故选C。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】过氧化钠(Na2O2)可用作呼吸面具的供氧剂。实验室有一瓶放置较长时间的过氧化钠样品,某研究小组对其成分和性质进行了如下探究。
[查阅资料]过氧化钠能与空气中水和二氧化碳反应生成氧气:
2Na2O2 +2H2O=4NaOH+O2↑
2Na2O2+2CO2 =2Na2CO3+O2
[提出问题]过氧化钠是否变质?
[提出猜想]猜想一:________;
猜想二:过氧化钠部分变质;
猜想三:过氧化钠全部变质。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
①取部分固体于试管中,加入适量水,在试管口插入带火星木条 | 固体溶解,有气泡产生_______ | 猜想三不成立 |
②取少量①中溶液于另一试管中,滴加足量_______,振荡 | 有气泡生成 | 猜想二成立 |
[反思评价]
(1)请写出实验②中产生气泡的化学反应方程式_________;
(2)小华同学想通过实验,进一步确定部分变质的过氧化钠中是否含有氢氧化钠,于是进行了如下的实验操作:取少量①中溶液于试管中,加入足量的氯化钙溶液,有白色沉淀生成,静置,向上层清液中加入少量________,溶液变红,证明部分变质的过氧化钠中含有氢氧化钠。
(3)小明同学认为,小华同学的实验仍无法确定原固体样品中是否含有氢氧化钠,理由是________。
【题目】普通干电池在生活中的用途很广。
(1)普通干电池照明时化学能转化为____。
(2)目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术。如图为普通电池(锌锰电池)示意图,请你根据图示将回收的废旧电池进行分离,可以得到的金属单质有(用化学式表示,下同)____,氧化物有___,盐有____,有机物有__(写名称)。
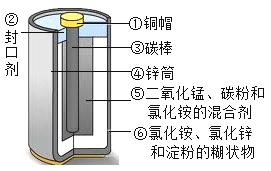
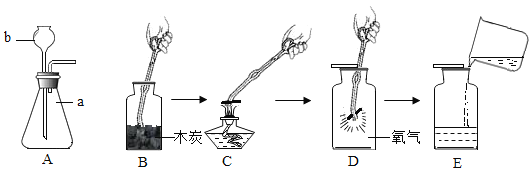
(3)小明同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子。设计了如下实验步骤,请你帮他完成。
实验步骤 | 实验现象 | 结论或解释 |
①剥开干电池,取出碳棒周围的黑色粉末 | ||
②溶解、___(填操作名称)、洗涤 | 得到黑色粉末和无色澄清液体 | 黑色粉末的成分为__。 |
③对黑色粉末进行__ | 得到纯净的MnO2固体 | |
④检验第②步中得到的无色澄清液体中是否含铵根离子的方法是:_____ | _____ | 化学方程式为:______ |
(4)对分离回收的铜帽净化处理,放入硝酸银溶液中,一段时间以后,可观察到的现象是__,反应的化学方程式是_____,其基本反应类型为___反应。
【题目】已知:碳酸钠的水溶液显碱性,氯化钙溶液显中性,碳酸钠能与氢氧化钙、氯化钙等反 应生成白色沉淀,化学方程式为:
①![]() ②Na2CO3+CaCl2=2NaCl+CaCO3↓
②Na2CO3+CaCl2=2NaCl+CaCO3↓
某化学兴趣小组的同学对敞口露置在空气中的氢氧化钠溶液进行探究,请你参与他们的探究活动:
(提出问题)氢氧化钠是否变质,溶液中溶质的成分是什么?
(猜想与假设)小红:氢氧化钠没有变质,溶液中的溶质为 NaOH; 小黄:氢氧化钠完全变质,请写出其变质的化学方程式_____;
小张:氢氧化钠部分变质,溶液中溶质为 Na2CO3 和 NaOH。
(实验探究)请设计实验证明小张的猜想
实验操作 | 实验现象 | 实验结论 |
①取适量样品溶液于试管中,滴加过量的 CaCl2 溶液,振荡,观察现象 | _____ | 溶液中含有 Na2CO3 |
②取适量①后的上层清液于试管中,滴 加几滴无色酚酞溶液,振荡,观察现象 | _____ | 溶液中含有 NaOH |
(问题反思)①实验操作①中加氯化钙而不加氢氧化钙的原因是:_____;
②若要检验氢氧化钠溶液是否变质,还可以取少量溶液于试管中,向其中加入足量_____ ,若有气泡冒出,证明氢氧化钠溶液已部分或完全变质, 反应的化学方程式为:_____ 。