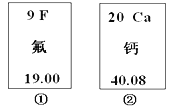
题目内容
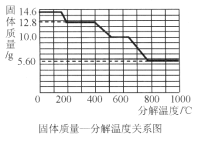
【题目】某研究所利用热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,获得相关数据,绘制成固体质量—分解温度的关系如图所示。下列说法正确的是
A.CaC2O4·xH2O中x=2
B.500~650℃范围内的残留固体为CaC2O4
C.固体质量由12.8g变为10.0g时发生的反应为CaC2O4![]() CaCO3 + CO↑
CaCO3 + CO↑
D.8000C以上时,固体成分的化学式为CaCO3
【答案】C
【解析】
A、根据图像可知0~200℃是晶体失去结晶水的过程,14.6克CaC2O4xH2O失去水后生成12.8克CaC2O4,根据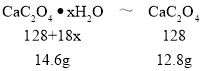
![]() 解得x═1,故A错误;
解得x═1,故A错误;
B、400℃时草酸钙分解,所以500~650℃范围内的残留固体不可能是CaC2O4,故B错误;
C、根据化学方程式CaC2O4![]() CaCO3+CO↑可知,每128份质量的草酸钙分解生成100份质量的碳酸钙和28份质量的一氧化碳,400℃时草酸钙分解,固体质量由12.8g变为10.0g时质量减少了12.8g-10g=2.8g,三种物质的质量比=12.8g:10.0g:2.8g=128:100:28,与化学方程式CaC2O4
CaCO3+CO↑可知,每128份质量的草酸钙分解生成100份质量的碳酸钙和28份质量的一氧化碳,400℃时草酸钙分解,固体质量由12.8g变为10.0g时质量减少了12.8g-10g=2.8g,三种物质的质量比=12.8g:10.0g:2.8g=128:100:28,与化学方程式CaC2O4![]() CaCO3+CO↑质量比相同,故C正确;
CaCO3+CO↑质量比相同,故C正确;
D、根据图像可知600℃时发生碳酸钙分解反应,800℃时分解完全,则800℃以上时,固体成分为氧化钙,故D错误。故选C。

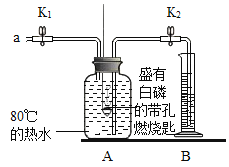
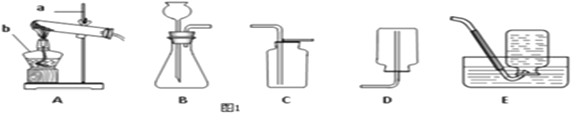
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验:
(实验一)(已知:白磷的着火点为40℃)
实验装置 | 实验步骤及现象 |
| 步骤1.检验装置的气密性,气密性良好 |
步骤2.将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧 | |
步骤3.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧 | |
步骤4.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2,此时进入量筒B中水的体积为120ml,观察A瓶中的白磷燃烧 |
(1)请写出白磷燃烧的化学方程式____________;
(2)对比步骤2和4的现象可知,可燃物燃烧的条件之一是_______________;
(3)待装置冷却一段时间后,打开K2,如果观察到__________,说明空气中氧气的体积约占1/5。若实验测得空冬中氧气的体积分数小于1/5,原因可能是________(答一条即可).
(实验二)(已知:铜能与空气中的氧气、水、二氧化碳反应生成铜绿,反应应的化学方程式为:2Cu+O2+H2O+CO2=Cu2(OH)2CO3)
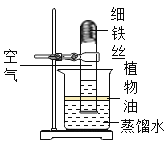
(4)用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量,图中植物油的作用是_________。荐将此装置中的细铁丝换成足量的细铜丝进行实验,不能较准确地测出空气中氧气的含量,请说明理由_____________。