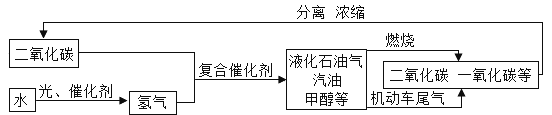
题目内容
【题目】认识物质的组成和结构,进而能推知物质的性质和用途。
(1)原子结构决定元索性质。
2016年6月8日,国际纯粹与应用化学联合会正式发布113号等四种新元素的英文名称和元素符号。2017年5月9日,我国发布了这四种元素的中文名称。其中113号的元素符号为Nh,中文名称为“鉨”。如图甲、乙分别为鉨原子和铝原子结构示意图。请回答下列问题:
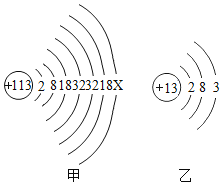
①在化学反应中,鉨原子形成离子的符号为________________。
②根据原子结构,理论上鉨的金属活动性比铝强,你认为可能的原因是________________。
(2)物质组成和结构决定其性质.性质决定其用途。
胃酸过多须服用抗酸药。下表为两种抗酸药的有效成分及其构成微粒:
抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
有效成分 | Mg( OH)2 | AlMg( OH)3CO3 |
构成微粒 | Mg2+、 OH- | Al3+、Mg2+、 OH-、 CO32- |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异。
①Mg( OH)2起抗酸作用的微粒是_______________(填微粒符号,下同);
②铝碳酸镁与盐酸反应的化学方程式为:![]() 。铝碳酸镁起抗酸作用的两种微粒是__________________________________。
。铝碳酸镁起抗酸作用的两种微粒是__________________________________。
【答案】Nh3+ 鉨原子最外层电子离核远比铝原子更容易失去 OH- OH-、CO32-
【解析】
(1)①鉨的核外层电子数=原子序数,113=2+8+18+32+32+18+x;x=3,在化学反应中,鉨原子容易失去三个电子,形成带3个单位正电荷的鉨离子,符号为Nh3+;
②根据原子结构,理论上鉨的金属活动性比铝强,原因是:鉨原子最外层电子离核远比铝原子更容易失去。
(2)
①Mg( OH)2起抗酸作用的微粒是OH-,因为氢氧根能与盐酸中的氢离子反应产生水;
②铝碳酸镁与盐酸反应的化学方程式为: ![]() 。铝碳酸镁起抗酸作用的两种微粒是OH-和CO32-。因为:氢氧根能与盐酸中的氢离子反应产生水;碳酸根能与盐酸中的氢离子反应产生二氧化碳和水。
。铝碳酸镁起抗酸作用的两种微粒是OH-和CO32-。因为:氢氧根能与盐酸中的氢离子反应产生水;碳酸根能与盐酸中的氢离子反应产生二氧化碳和水。

【题目】过氧化钙(CaO2)是一种环境友好型供氧剂,可用于鱼类养殖、农作物栽培等,实验室有一瓶放置一段时间的过氧化钙样品,某兴趣小组对其成分展开了如下探究。
(查阅资料)CaO2能与水反应最终生成Ca(OH)2和O2;也能与CO2反应得到CaCO3和O2.过氧化氢溶液具有漂白性。
(提出问题)该固体样品的成分是什么?
(猜想假设)可能是CaO2、Ca(OH)2、CaCO3中的一种或几种。
(实验探究)
实验编号 | 实验步骤 | 实验现象 |
① | 取少量样品于试管中,加入一定量的水,一段时间后,在试管口插入带火星的木条 | 得到浊液,有气泡产生,木条复燃 |
② | 另取少量样品于试管中,滴加适量的试剂X,并将产生的气体通入澄清石灰水 | 得到澄清溶液,有气泡产生,生成的气体使石灰水变浑浊 |
③ | 室温下,取①中上层清液,用pH试纸测定溶液的pH | pH约为12 |
(得出结论)
(1)由实验①②可知,白色固体中肯定有_____。
(2)实验②中所加试剂X可以是_____(填字母序号)。
A 稀硫酸 B 稀盐酸 C 水 D 氢氧化钠溶液
(3)根据实验③_____(填“能”或者“不能”)判断原固体样品中含有Ca(OH)2,理由是_____。
(反思交流)(4)过氧化钙敞口放置在空气中,最终会变质为_____(填化学式),原因是_____。
(改进实验)(5)该兴趣小组在老师指导下,用装置甲进行少量过氧化钙样品与足量水反应的实验,实验时加入过氧化钙样品与足量水,迅速密闭装置,开始测氧气浓度。滴入几滴酚酞试液,观察到三颈烧瓶中溶液先变红后慢慢褪色。620秒时,将气球内二氧化锰加入三颈烧瓶中,瓶内氧气浓度随反应时间变化如图乙。

①AB段氧气浓度几乎不变的原因可能是_____;
②滴入酚酞试液后,三颈烧瓶中溶液变红后会慢慢褪色的原因可能是_____。
【题目】某化学兴趣小组使用如图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入20.0g合金样品。开始计时,并将电子天平的读数记录在下表中,请回答下列问题:

空烧杯 | 加入硫酸后 | 加入合金后5分钟 | 加入合金后12分钟 | 加入合金后21分钟 | 加入合金后40分钟 | 加入合金后3小时 | |
读数(g) | 28.5 | 169.7 | 189.6 | 189.5 | 189.4 | 189.3 | 189.3 |
(1)合金中锌元素的质量分数为多少?
(2)完全反应后.烧杯中盐的质量为多少克? (计算结果精确至0.1g)