题目内容
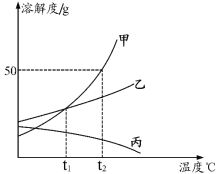
【题目】甲乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
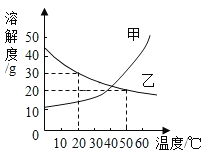
A.50℃时,100g水中加入20g乙并降温至20℃,溶液中溶质的质量分数不变
B.20℃时,可配制溶质质量分数为30%的乙溶液
C.20℃时,50g水中加入20g乙可得到饱和溶液70g
D.20℃时,甲的某一溶液中的溶质质量分数一定小于乙的某一溶液的质量分数
【答案】A
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
A.50℃时,100g水中加入20g乙并降温至20℃,溶解度是20g,不会析出晶体,所以溶液中溶质的质量分数不变,符合题意;
B.20℃时,乙物质的溶解度是30g,所以饱和溶液的质量分数为:![]() ×100%=23.1%,所以不可配制溶质质量分数为30%的乙溶液,不符合题意;
×100%=23.1%,所以不可配制溶质质量分数为30%的乙溶液,不符合题意;
C.20℃时,乙物质的溶解度是30g,所以50g水中最多溶解15g乙,可得到饱和溶液为65g,不符合题意;
D.20℃时,甲、乙溶液的状态不能确定,所以甲的某一溶液中的溶质质量分数不一定小于乙的某一溶液的质量分数,不符合题意。故选A。

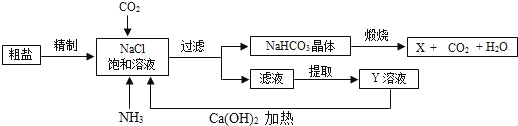
【题目】硫酸镁晶体(MgSO4﹒7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶于水、也不溶于酸的杂质)为原料制取硫酸镁晶体的流程如下:

已知:部分氢氧化物沉淀时溶液的pH见下表:
物质名称 | Mg(OH)2 | Fe(OH)3 |
开始沉淀 | 9.1 | 1.9 |
完全沉淀 | 11.1 | 3.2 |
(1)“浸取”步骤中,MgCO3 溶于稀硫酸的化学方程式为_______。
(2)“氧化”步骤中,加入H2O2溶液会生成Fe2(SO4)3和水,该反应的化学方程式是_____________。
(3)“沉淀”步骤中,用氨水调节溶液的pH范围为_______,其目的是________。
(4)“过滤”所得滤液中含有的阳离子为_________(写离子符号)。
(5)“结晶”步骤中需蒸发浓缩滤液,当蒸发皿中_______时 即可停止加热。
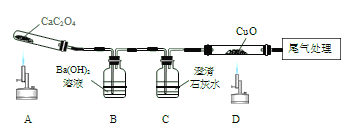
【题目】某课题组探究草酸锰(MnC2O4)受热分解的产物。
I.探究气态产物。取少量草酸锰按如图1所示的装置进行实验,加热使固体完全分解。
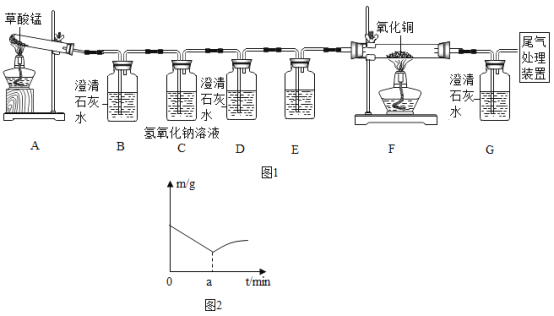
查阅资料:氢氧化钠和氢氧化钙的化学性质相似,但相同温度下氢氧化钠的溶解度比氢氧化钙的溶解度大得多。
(1)B、G、D瓶盛装的试剂均是澄清石灰水,B、G瓶中试剂作用均相同,其作用为_____。D装置的作用是_____。
(2)你设计的尾气处理装置为:_____。
(3)B瓶中出现浑浊,D装置在实验过程中没有出现浑浊,G瓶中变浑浊。F装置中黑色粉末变红色,F装置中发生反应的方程式为_____。通过上述实验证明草酸锰受热分解的气态产物为_____。
Ⅱ.探究固体产物
(提出假设)
根据反应原理,提出如下假设:
假设1 固体产物为Mn。
假设2 固体产物为MnO。
假设3 固体产物为_____。
(查阅资料)
①在金属活动性顺序表中,锰介于铝与锌之间。②氧化锰(MnO)是灰绿色粉末。不溶于水,可溶于酸。③氧气、高锰酸钾溶液等能将Mn2+氧化成二氧化锰。
(4)(设计实验)设计如下实验方案验证固体产物:
实验 | 操作过程及实验现象 |
Ⅰ | 将少量固体产物加入稀盐酸中,无气泡产生 |
Ⅱ | 取少量固体产物溶于稀硫酸中,滴加高锰酸钾溶液,产生黑色沉淀 |
(实验评价)述实验中,能证明固体成分的实验是_____(填序号)。理由是_____。
(5)(实验结论)根据上述实验结论:写出草酸锰受热分解的化学反应方程式:_____。
(6)(实验反思)
某同学将143克草酸锰在空气中灼烧,固休质量与灼烧时间的关系曲线如图2所示。在a min之后,固体质量增加的原因是_____。
“物质的量”是国际基本物理量之一,单位为摩尔,符号为mo1,1molCO质量为28克,1molCO2质量为44克,求a min时143克草酸锰分解产生的气体物质的量共为_____mol。