题目内容
【题目】我国制碱工业的先驱侯德榜发明了将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献,其生产工艺流程示意图如图:
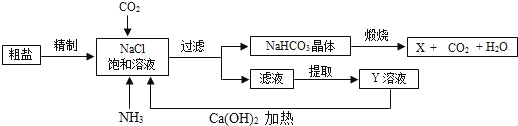
(查阅资料)粗盐中含有CaCl2、MgCl2等可溶性杂质。
(1)粗盐水精制的过程中先加过量的NaOH溶液,发生反应的化学方程式是_____________;再加入过量的碳酸钠溶液,其目的是除尽__________(填名称)。
(2)煅烧后的产物X 是一种盐,写出其化学式:__________。
(3)Y是滤液中的主要成分,可作氮肥,但不能与碱性物质混合施用,原因是________________。
(4)该流程中可用于循环使用的物质有氨气和__________(填名称)。
【答案】2NaOH+MgCl2=Mg(OH)2↓+2NaCl;氯化钙;Na2CO3;与碱性物质反应能释放氨气,降低肥效;二氧化碳。
【解析】
(1)由于氯化镁与氢氧化镁反应生成了氢氧化镁沉淀和氯化钠,化学方程式为2NaOH+MgCl2=Mg(OH)2↓+2NaCl;所以,在粗盐提纯的过程中加入过量的NaOH溶液,其目的是除尽MgCl2;碳酸钠与氯化钙反应反应生成了碳酸钙沉淀和氯化钠,加入过量的碳酸钠溶液除去氯化钙;
(2)碳酸氢钠煅烧生成碳酸钠、水、二氧化碳,所以X是碳酸钠,其化学式是:Na2CO3;
(3)Y是氯化铵,是滤液中最主要成分,其化学式为NH4Cl,铵态氮肥与碱性物质反应能释放氨气,降低肥效;
(4)由图可知可用于循环使用的物质有氨气和二氧化碳。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目