题目内容
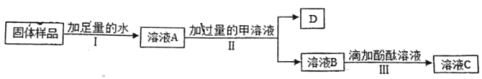
【题目】硫酸镁晶体(MgSO4﹒7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶于水、也不溶于酸的杂质)为原料制取硫酸镁晶体的流程如下:

已知:部分氢氧化物沉淀时溶液的pH见下表:
物质名称 | Mg(OH)2 | Fe(OH)3 |
开始沉淀 | 9.1 | 1.9 |
完全沉淀 | 11.1 | 3.2 |
(1)“浸取”步骤中,MgCO3 溶于稀硫酸的化学方程式为_______。
(2)“氧化”步骤中,加入H2O2溶液会生成Fe2(SO4)3和水,该反应的化学方程式是_____________。
(3)“沉淀”步骤中,用氨水调节溶液的pH范围为_______,其目的是________。
(4)“过滤”所得滤液中含有的阳离子为_________(写离子符号)。
(5)“结晶”步骤中需蒸发浓缩滤液,当蒸发皿中_______时 即可停止加热。
【答案】![]()
![]()
![]() 使硫酸铁全部转化氢氧化铁沉淀而除去 Mg2+和NH4+ 有较多晶体析出
使硫酸铁全部转化氢氧化铁沉淀而除去 Mg2+和NH4+ 有较多晶体析出
【解析】
(1)MgCO3 溶于稀硫酸生成硫酸镁、水和二氧化碳气体,化学方程式为![]() 。
。
(2)在酸性的条件下,在含有硫酸亚铁溶液中加入H2O2溶液会生成Fe2(SO4)3和水,该反应的化学方程式是![]() 。
。
(3)在“沉淀”步骤中,目的是先把硫酸铁转化为氢氧化铁沉淀除去,根据溶液的pH表,当溶液的pH等于3.2时,氢氧化铁完全沉淀,当溶液的pH等于9.1,氢氧化镁开始产生沉淀。所以用氨水调节溶液的pH范围为![]() ,其目的是使硫酸铁全部转化氢氧化铁沉淀而除去。
,其目的是使硫酸铁全部转化氢氧化铁沉淀而除去。
(4)氧化钙、氧化镁加硫酸溶解后,得到的滤液是硫酸钙和硫酸镁,硫酸钙微溶于水,过滤得到硫酸镁,加入氨水可以生成氢氧化镁沉淀和硫酸铵,加热可以使水中的氨气挥发,所以“过滤”所得滤液中含有的阳离子为Mg2+和NH4+。
(5)在蒸发浓缩滤液操作中,当蒸发皿有较多晶体析出时 即可停止加热,利用余热把剩下的水分蒸干。

 名校课堂系列答案
名校课堂系列答案