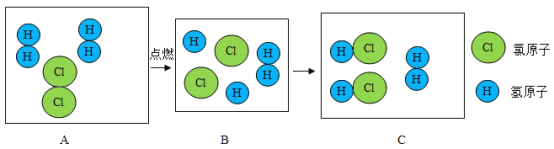
题目内容
【题目】希溪同学在实验室里测定溶液中溶质的质量分数进行了如下实验,他取了锌和硫酸锌的混合物 22.6g,加入了 100g9.8%的稀硫酸,恰好完全反应,然后加入77.6g 水,得到不饱和溶液,流程图如下:
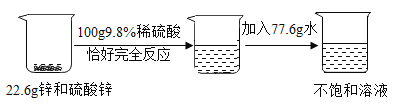
请根据上述内容回答下列问题:
(1)写出反应的化学方程式______________ ;
(2)根据已知条件列出参加反应锌的质量(X)的比例式_____________ ;
(3)反应后所得的不饱和溶液中溶质的质量分数是_______________ ;
(4)上述所用的 100 克 9.8%的稀硫酸是由 98%浓硫酸配制,需加入水的质量是_________;
(5)浓硫酸配成稀硫酸所用的仪器除了烧杯、玻璃棒外,还需的仪器是_____________ 。
【答案】Zn + H2SO4=ZnSO4+H2↑ ![]() 或
或![]() 16.1% 90g 量筒和胶头滴管
16.1% 90g 量筒和胶头滴管
【解析】
(1)锌和稀硫酸反应生成硫酸锌和氢气;
(2)100 克 9.8%的稀硫酸中的溶质质量为100g× 9.8%=9.8g;
(3)根据硫酸质量计算锌的质量、生成硫酸锌的质量、同时得到氢气质量,最后计算
反应后所得的不饱和溶液中溶质的质量分数;
(4)溶液加水稀释过程中,溶质质量不变;
(5)量取液体的仪器是量筒和胶头滴管。
(1)锌和稀硫酸反应生成硫酸锌和氢气,化学方程式为Zn + H2SO4=ZnSO4+H2↑;
(2)100 克 9.8%的稀硫酸中的溶质质量为100g× 9.8%=9.8g,根据已知条件列出参加反应的锌质量(X)的比例式![]() 或
或![]() ;
;
(3)设锌的质量为x,生成硫酸锌的质量为y,同时得到氢气质量为z。
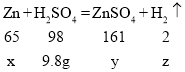
![]() ,x=6.5g,y=16.1g,z=0.2g。
,x=6.5g,y=16.1g,z=0.2g。
反应后所得的不饱和溶液中溶质的质量分数是![]() ;
;
(4)上述所用的 100 克 9.8%的稀硫酸是由 98%浓硫酸配制,需加入水的质量是100g-9.8g÷98%=90g;
(5)浓硫酸配成稀硫酸所用的仪器除了烧杯、玻璃棒外,还需的仪器是量筒和胶头滴管。

 阅读快车系列答案
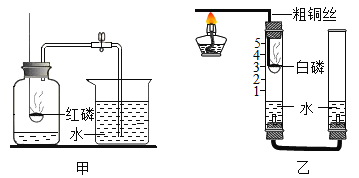
阅读快车系列答案【题目】如图是初中化学中验证物质性质的几个基本实验,回答下列问题。
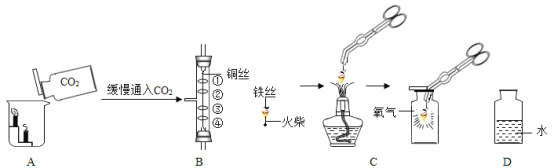
(1)将一瓶二氧化碳倒入盛有阶梯形蜡烛的烧杯中(如图A),观察到的现象是_____,此实验说明二氧化碳气体的性质有:________。
(2)如图B所示,其中①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球,实验过程中观察到的现象是:②、③不变红,①和④都变红且④比①先变红。据此现象推知二氧化碳的性质有____,反应的文字或化学符号表达式为______________。
(3)按C图实验时,集气瓶底部炸裂,其原因是_____________。
(4)某化学兴趣小组的同学探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如下:
氧气体积分数(%) | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 复燃 | 复燃 |
在集气瓶中注入占其容器50%的水(如图D所示,空气中氧气的体积分数为21%),用排水法收集氧气,将瓶内的水排尽,用带火星的木条在该集气瓶中进行实验,通过计算,该集气瓶收集的气体中氧气体积分数为_______,推测带火星的木条能否复燃______(填“能”或“否”)。
【题目】探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比.
实验中采用图1实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中.在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200ml氧气所消耗的时间.实验记录的数据如下:
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰的质量(g) | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200ml氧气时间(秒) | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
请回答下列问题:
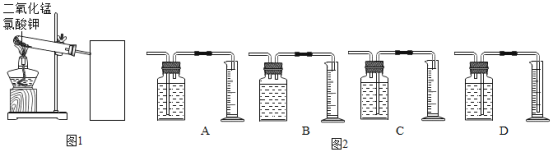
(1)为完成本实验,方框内应选择图2气体收集装置中的是_____(选填序号)该收集利用了氧气的_____性质.收集气体前集气瓶内未装满水,对实验结果_____(填“有”或“没有”)影响.
(2)分析上述数据,你认为利用此法制氧气,二氧化锰与氯酸钾的最佳质量比为_____.
(3)利用双氧水和二氧化锰的混合物制氧气比加热氯酸钾和二氧化锰混合物制氧气更好,请写出前者的两个优点①_____②
(4)催化剂能影响化学反应速度,温度、反应物的浓度、接触面积等也会对化学反应速度带来影响.分析上表数据,结合影响化学反应速度的
①当二氧化锰与氯酸钾的质量比高于最佳质量比时,反应速度变低的原因是_____.
②当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是_____.