题目内容
【题目】下列化学方程式符合题意且书写和所属基本反应类型均正确的是( )
A. 不能用铁器盛放硫酸铜溶液的原因:Fe+CuSO4=FeSO4+Cu 置换反应
B. 铝耐腐蚀的原因:4Al+3O2=Al2O3 氧化反应
C. 工业上以赤铁矿为原料冶炼生铁:2Fe2O3+3C![]() 4Fe+ 3CO2↑ 还原反应
4Fe+ 3CO2↑ 还原反应
D. 电解水产生氢气和氧气:2H2O![]() 2H2↑+ O2 ↑ 分解反应
2H2↑+ O2 ↑ 分解反应
【答案】A
【解析】
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确;若化学方程式正确,再判断反应类型是否正确。
A、该化学方程式书写完全正确,且该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故A选项正确。
B、该化学方程式配平错误,正确的化学方程式应为![]() ,且氧化反应不是基本的反应类型,故B选项错误。
,且氧化反应不是基本的反应类型,故B选项错误。
C、工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,正确的化学方程式为![]() ,且还原反应不是基本反应类型,故C选项错误。
,且还原反应不是基本反应类型,故C选项错误。
D、该化学方程式的反应条件应为通电,正确的化学方程式应为![]() ,故D选项错误。
,故D选项错误。
故选:A。

【题目】请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为______g,所需蒸馏水的体积为______mL(水的密度约为1g/mL)。
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应______(填字母序号)。
A先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡
B先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡
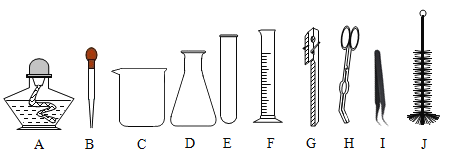
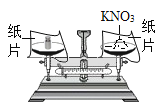
(探究一):在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性______(填“有”或“没有”)影响,理由是______。
(3)量取:准确量取所需蒸馏水要用到的仪器是____(“少写”或“多写”均不得分)。
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解。
(探究二):20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的密度数据为:______g/mL。
温度℃ 质量分数% | 20 | 40 | 60 |
4 | 1.023 | 1.016 | 1.007 |
10 | 1.063 | 1.054 | 1.044 |
(探究三):已知硝酸钾在部分不同温度时的溶解度如下表
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 31.6 | 63.9 | 110 | 169 | 246 |
(5)20℃时25 g硝酸钾溶解在50 g水中,所得溶液为______溶液(填“饱和”或“不饱和”),其溶质质量分数为______。
(6span>)将80℃时269g的硝酸钾饱和溶液降温至60℃时(不考虑水分蒸发),所析出晶体的质量是___g。