题目内容
【题目】牙膏中常用轻质碳酸钙粉末作摩擦剂。下图是工业上以石灰石为原料制取轻质碳酸钙,并获得副产品氢氧化钠的流程图(假设杂质不溶于水也不反应)。下列说法正确的是()
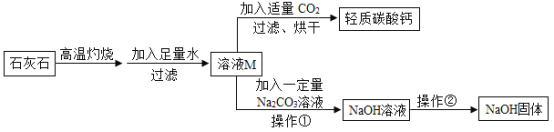
A.高温煅烧石灰石的反应原理为 CaCO3=CaO + CO2↑
B.实验室中进行操作①和操作②时均会用到玻璃棒,且作用相同
C.流程图中所有元素的化合价均没有发生改变
D.为检验溶液 M 与碳酸钠溶液是否恰好反应,可取反应后上层清液,滴加酚酞试液
【答案】C
【解析】
碳酸钙高温生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠。
A、高温煅烧石灰石的反应原理为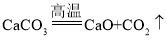 ,故A不正确;
,故A不正确;
B、实验室中操作①玻璃棒是搅拌加快反应,操作②玻璃棒是搅动加快蒸发,作用不同,故B不正确;
C、碳酸钙高温生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,则流程图中所有元素的化合价均没有发生改变,故C正确;
D、溶液M是氢氧化钙溶液,显碱性,碳酸钠溶液显碱性,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,上层清液仍显碱性,检验溶液M与碳酸钠溶液是否恰好反应,取反应后上层清液,滴加酚酞试液,无法判断是否完全反应,故D不正确。故选C。

练习册系列答案
相关题目