题目内容
【题目】石灰石是常用的建筑材料。化学小组同学取一定量石灰石高温煅烧一段时间,冷却后,对剩余固体成分进行如下探究。
(1)写出石灰石高温煅烧的化学方程式___。
(2)根据化学方程式进行猜想。固体残留物成分:
I.只有氧化钙;II.只有碳酸钙;III.___
(3)甲乙丙三位同学分别设计了实验探究煅烧后固体成分。
友情提示:氯化钙溶液呈中性。
①甲同学取一定量的剩余固体于试管中,加入一定量的水振荡,用温度传感器测出溶液的温度,结果如图。则固体物质中一定含有___,用化学方程式解释判断的理由___。

②乙同学取一定量的剩余固体于试管中,加入足量的稀盐酸,待充分反应后,滴加酚酞试液,溶液呈无色。乙同学据此认为试管中的固体只有碳酸钙,即猜想 II成立。该同学设计方案是否合理,理由是___。
③丙同学利用水、无色酚酞溶液和稀盐酸证明了猜想III成立,请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量剩余固体于试管中,加水振荡,过滤。 | 猜想III成立 | |
___ | ___ | |
___ | ___ |
【答案】CaCO3![]() CaO+CO2↑ 氧化钙和碳酸钙 氧化钙 CaO+H2O=Ca(OH)2 不合理 这是因为加足量盐酸时,无论是否含有氧化钙,实验现象都一样 取滤液滴加无色酚酞溶液 溶液变红 取滤渣滴加足量的稀盐酸;有气泡产生
CaO+CO2↑ 氧化钙和碳酸钙 氧化钙 CaO+H2O=Ca(OH)2 不合理 这是因为加足量盐酸时,无论是否含有氧化钙,实验现象都一样 取滤液滴加无色酚酞溶液 溶液变红 取滤渣滴加足量的稀盐酸;有气泡产生
【解析】
碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,氢氧化钙和稀盐酸反应生成氯化钙和水。
(1)碳酸钙高温能分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3![]() CaO+CO2↑。
CaO+CO2↑。
(2)若碳酸钙部分分解,则固体残留物成分为氧化钙和碳酸钙。
(3)①甲同学取一定量的剩余固体于试管中,加入一定量的水振荡,用温度传感器测出溶液的温度,温度升高,则说明该物质溶于水放热,则固体物质中一定含有氧化钙,氧化钙与水反应生成氢氧化钙,放出热量,反应的化学方程式为CaO+H2O=Ca(OH)2。
②取一定量的剩余固体于试管中,加入足量的稀盐酸,待充分反应后,滴加酚酞试液,溶液呈无色,说明溶液呈中性或酸性,产生上述现象,剩余固体可以是氧化钙、碳酸钙、或氧化钙与碳酸钙的混合物,所以认为只有碳酸钙不合理,因为加足量盐酸时,无论是否含有氧化钙,实验现象都一样。
③氧化钙与水反应生成氢氧化钙,氢氧化钙和稀盐酸反应生成氯化钙和水,利用水、无色酚酞溶液证明氧化钙与水反应生成氢氧化钙,用稀盐酸证明碳酸钙存在。
实验步骤 | 实验现象 |
取少量剩余固体于试管中,加水振荡,过滤 取滤液滴加无色酚酞溶液 取滤渣滴加足量的稀盐酸 | 溶液变红 有气泡产生 |

 夺冠金卷全能练考系列答案
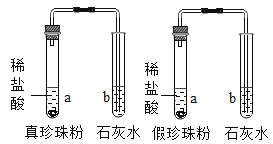
夺冠金卷全能练考系列答案【题目】珍珠粉是由珍珠加工制成的白色粉末,主要成分是碳酸钙,是重要的化妆品原料,市场上出现的假珍珠粉外观上与真珍珠粉差不多,肉眼无法辨别它们。
(提出问题)假珍珠粉的主要成分是什么?真假珍珠粉的差别在哪里?
(作出猜想)①含有碳酸钙;②含有蛋白质;③含有碳酸钙和蛋白质
(实验一)为了确认珍珠粉的组成,同学们进行了下列实验:
操作方法 | 结论与化学反应方程式 |
| 通过a、b实验及其他手段,证明了二者都含有碳酸钙。b中化学反应方程式: _________________ |
判断真、假珍珠粉中是否含蛋白质的方法是: ______________________ | 真珍珠粉中含有蛋白质,假珍珠粉中不含蛋白质。 |
(拓展实验)将a中完全反应后的混合物过滤,测得滤液的![]() ,是什么物质使滤液的
,是什么物质使滤液的![]() ?小羽和小吴分析后认为只有两种可能性并作了猜想:猜想①:反应后生成的碳酸 猜想②:反应后剩余的盐酸
?小羽和小吴分析后认为只有两种可能性并作了猜想:猜想①:反应后生成的碳酸 猜想②:反应后剩余的盐酸
(实验二)小明和小吴用下列实验对猜想进行验证。
实验操作 | 实验现象 | 实验结论 |
向蒸馏水中通入________至饱和,测pH | pH约为5.6 | 猜想①错误 |
向滤液中滴入石蕊试液,然后加热至沸腾 | ________________ | 猜想②正确 |
写出猜想①发生的化学反应方程式__________________。