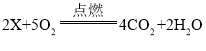题目内容
【题目】某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
第一站:初识金属镁。
(1)金属镁的物理性质:_____________(写一条)。
(2)金属镁的化学性质:镁能与氧气反应,反应的化学方程式为_______________。
第二站:再遇金属镁。
探究镁与盐酸反应过程中的能量变化以及反应速率的变化。
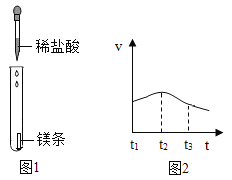
(1)实验时需将镁条进行打磨,其目的是_____________。
(2)如图1将稀盐酸逐滴滴入。放有镁条的试管中,反应中试管外壁发烫,说明镁与稀盐酸反应是_______反应(填“吸热”或“放热”),化学方程式为____________。
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图2所示,则t1-t2时间内反应速率逐渐加快的主要原因是____________。
第三站:再探金属镁
(提出问题)金属镁能否与热水反应?如果反应,产物是什么?
(相关信息)①氢氧化镁在热水中能部分溶解,其溶液显碱性,在常温下不溶于水:
②无色酚酞遇碱性溶液变红。
(实验探究)填写下表:
实验操作 | 实验现象 | 实验结论 |
_______________ | 气体被点燃,发出淡蓝色火焰 | 镁能与热水反应生成氢气 |
______________ | ___________ | 镁能与热水反应生成氢化镁 |
根据以上实验,写出该反应的化学方程式___________。
第四站:实验总结应用。
总结上述寻镁之旅中你收获到镁的化学性质有____________(要写全)。金属镁有广泛用途,请举一例_________。
【答案】银白色固体 ![]() 除去金属表面的氧化物 放热
除去金属表面的氧化物 放热 ![]() 镁与盐酸反应放热,温度越高,反应速率越快 将打磨好的镁条放入盛有热水的试管中,收集气体并将气体点燃 反应后向热试管中滴入酚酞溶液 溶液由无色变成红色
镁与盐酸反应放热,温度越高,反应速率越快 将打磨好的镁条放入盛有热水的试管中,收集气体并将气体点燃 反应后向热试管中滴入酚酞溶液 溶液由无色变成红色 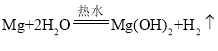 能与氧气反应、能与酸反应、能与热水反应 做照明弹或制烟花(合理即可)
能与氧气反应、能与酸反应、能与热水反应 做照明弹或制烟花(合理即可)
【解析】
第一站:(1)金属镁的物理性质是银白色的固体;
故填:银白色固体。
(2)镁与氧气反应就是镁和氧气在点燃的条件下反应生成氧化镁,化学方程式是![]() ;
;
故填:![]() 。
。
第二站:(1)打磨镁条是除去金属表面的氧化物;
故填:除去金属表面的氧化物。
(2)将稀盐酸逐滴滴入放有镁条的试管中,试管外壁发烫,说明镁与稀盐酸反应放出热量,也就是镁与盐酸反应生成氯化镁和氢气,化学方程式是![]() ;
;
故填:放热;![]() 。
。
(3)根据图2中,速率(v)与时间(t)的关系,则t1-t2时间内反应速率逐渐加快的主要原因是镁与盐酸反应放热,温度越高,反应速率越快;
故填:镁与盐酸反应放热,温度越高,反应速率越快。
第三站:[实验探究]根据题目所给信息,①氢氧化镁在热水中能部分溶解,其溶液显碱性,在常温下不溶于水;②无色酚酞遇碱性溶液变红可得:
实验操作 | 实验现象 | 实验结论 |
将打磨好的镁条放入盛有热水的试管中,收集气体并将气体点燃 | ||
反应后向热试管中滴入酚酞溶液 | 溶液由无色变成红色 |
根据以上实验可知,镁与热水反应生成氢氧化镁和氢气,反应的化学方程式是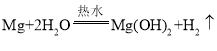 ;
;
故填:将打磨好的镁条放入盛有热水的试管中,收集气体并将气体点燃;反应后向热试管中滴入酚酞溶液;溶液由无色变成红色;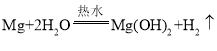 。
。
第四站:镁的化学性质有①能与氧气反应;②能与酸反应;③能与热水反应。金属镁的用途有:做照明弹或制烟花(合理即可);
故填:能与氧气反应、能与酸反应、能与热水反应;做照明弹或制烟花(合理即可)。

【题目】随着我国的发展,金属在生活生产中应用越来越广泛,请回答以下问题:
(1)家用电线常用铜制,但在高压远距离输电中,常用铝代替铜,请根据下图的信息分析,其原因是_____________。
铜 | 铝 | |
密度(g/cm3) | 8.92 | 2.70 |
地壳中量(质量分数/%) | 0.007 | 7.73 |
导电性(以银的导电性100作为标准) | 铜 铝 (优)99 61(良) | |
(2)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有_______(填字母序号)。
A金属原料的成本
B生成过程中的能耗和污染
C金属的回收利用
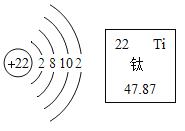
(3)钛和钛合金是21世纪的重要的金属材料。2019年1月,嫦娥四号和玉兔二号互拍成像,实现了探月工程五战五捷。
①航天器的天线用钛合金制成,钛合金与金属钛相比,____________的硬度更大。工业上通常是在高温下用四氯化钛(TiCl4)与金属镁发生置换反应获得,该反应的化学方程式为______________。
②航天器上的太阳能电池是将太阳能直接转化为____________能的装置,大自然利用太阳能最成功的范例是__________(填字母序号)。
A火山爆发 B温室效应 C光合作用