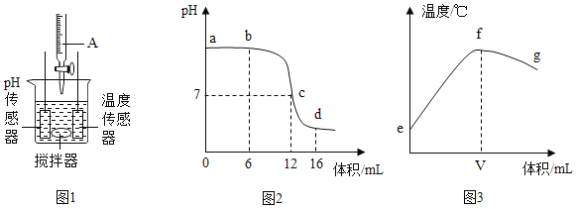
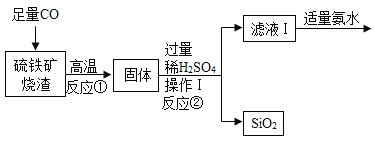
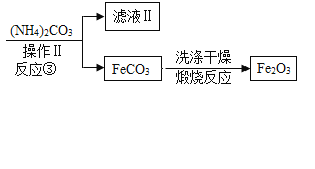
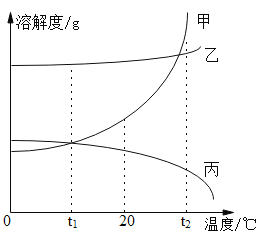
题目内容
【题目】某工厂欲测定铝土矿中A12O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
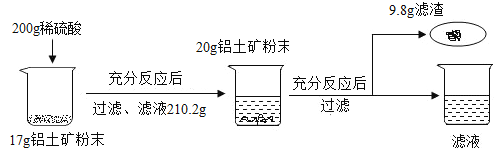
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为_____;
(2)铝土矿中A12O3的质量分数为_____;
(3)根据已知条件列出求解200g稀盐酸中溶质质量(X)的比例式_____;
(4)若将最终所得溶液蒸发掉20.4g水,所得不饱和溶液中溶质的质量分数为_____;
(5)用浓盐酸配置上述稀盐酸,需要的仪器有:烧杯、量筒、胶头滴管和_____;
(6)该炼铝厂每天用上述铝土矿170t来生产铝合金,则理论上日产含镁46%的铝镁合金的质量为_____。
【答案】Al2O3+6HCl=2AlCl3+3H2O 60% ![]() 26.7% 玻璃棒 100t
26.7% 玻璃棒 100t
【解析】
(1)氧化铝和稀盐酸可以生成氯化铝和水,化学方程式为Al2O3+6HCl=2AlCl3+3H2O,故填:Al2O3+6HCl=2AlCl3+3H2O;
(2)第一次加17g铝土矿粉末得溶液质量210.2g,第二次加20g铝土矿粉末根据质量守恒滤液质量为210.2g+20g-9.8g=220.4g,滤液质量增加说明刚开始稀盐酸过量,17g铝土矿中氧化铝完全反应,则氧化铝质量210.2g-200g=10.2g,则氧化铝质量分数![]() ,故填:60%;
,故填:60%;
(3)样品中杂质总质量37g×(1-60%)=14.8g,第一次过滤得杂质200g+17g-210.2g=6.8g第二次过滤得杂质9.8g,6.8g+9.8g>14.8g,所以滤渣中应该会有未完全反应的氧化铝,稀盐酸不足,则反应的氧化铝质量37g-6.8g-9.8g=20.4g设稀盐酸中溶质质量为x生成氯化铝质量为y
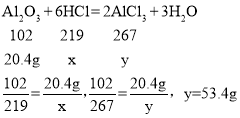
故比例式为: ![]()
(4)溶质质量53.4g,溶液质量200g+20.4g-20.4g=200g;故溶质质量分数
![]()
(5)用浓盐酸配置上述稀盐酸,需要的仪器有:烧杯、量筒、胶头滴管和玻璃棒,故填:玻璃棒;
(6)设生成合金质量为z,根据质量守恒反应前后元素质量不变,
![]() ,x=100t,故镁铝合金质量100t,
,x=100t,故镁铝合金质量100t,
故填:100t

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】黄铜是铜和锌的合金![]() ,为了测定黄铜样品中锌的质量分数,现将80g稀硫酸平均分成4份,分别与一定质量的黄铜样品进行实验,每次充分反应后,测定生成氢气的质量数据如下表:
,为了测定黄铜样品中锌的质量分数,现将80g稀硫酸平均分成4份,分别与一定质量的黄铜样品进行实验,每次充分反应后,测定生成氢气的质量数据如下表:
实验次数 | 一 | 二 | 三 | 四 |
黄铜样品质量/g | 1 | 2 | 3 | 4 |
生成氢气质量/g | 0.02 | 0.04 | 0.05 | M |
(1)从第_____次实验开始黄铜样品有剩余;
(2)M=_____;
(3)黄铜样品中锌的质量分数?_____(写出具体的计算过程![]()
【题目】分类、类比是学习化学常用的方法。
(1)初中化学实验方法有多种,如对比法、控制变量法、定量实验法、定性实验法等,若按实验方法分类,应将实验 ________________________(填字母)分为一类,依据是______________________________。
用pH 试纸测定溶液的pH |
探究铁生锈条件 |
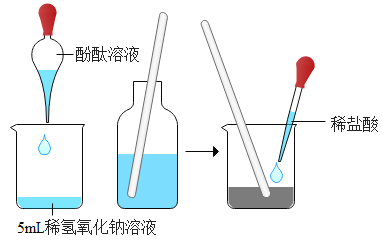
探究氢氧化钠溶液与盐酸反应 |
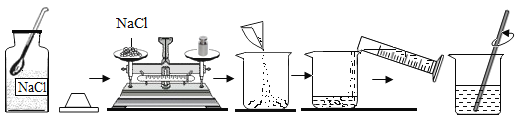
配置质量分数5%的NaCl 溶液 |
A | B | C | D |
(2)善于比较、归纳是良好的学习习惯。酸酐能与水化合生成相应的酸。依据酸酐中元素的化合价与酸中元素的化合价存在的规律,写出硝酸酸酐的化学式__________________;请写出三氧化二氮与水反应生成相应酸的化学方程式_______________________。
酸酐 | 酸 | 酸酐 | 酸 |
CO2 | H2CO3 | SO3 | H2SO4 |
Cl2O7 | HClO4 | ? | HNO3 |