题目内容
【题目】一凡同学对生铁的组成进行研究,称取生铁样品 40g,把 500g 稀硫酸分 5 次加入样品中, 测得实验数据见下表:(杂质不溶于水,也不和稀硫酸反应)
实验序号 | 加入稀硫酸的质量/g | 剩余固体的质量/g |
第 1 次 | 100 | 28.8 |
第 2 次 | 100 | 17.6 |
第 3 次 | 100 | M |
第 4 次 | 100 | 1.2 |
第 5 次 | 100 | N |
(1)第 3 次剩余固体的质量 M=_____第 5 次剩余固体的质量 N=_____
(2)该生铁样品中铁的质量分数为_____。
(3)计算第 3 次反应结束后所得溶液的溶质质量分数。_____(写出计算过程,保留一位小数)
【答案】6.4 1.2 97% 27.4%
【解析】
(1)每100g的硫酸完全反应,反应掉的铁的质量是11.2g,由于在第4次时剩余混合物的质量总共有1.2g,由于17.6g-1.2g=16.4g,11.2g<16.4g<11.2g×2,所以第3次硫酸完全反应,剩余固体的质量为17.6-11.2g=6.4g;第4次硫酸有剩余,剩余固体不再与硫酸反应,第五次剩余的杂质是1.2g,所以M=6.4,N=1.2,故填:6.4;1.2。
(2)该生铁样品中铁的质量分数为:![]() =97%;
=97%;
(3)设第3次反应结束后得溶液的FeSO4溶质质量为x,产生氢气的质量为y。反应掉的铁的质量为:40g-6.4g=33.6g。
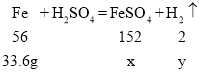
![]()
解得:x=91.2g;y=1.2g。
得溶液的溶质质量分数为:![]() 。
。
答:第 3 次反应结束后所得溶液的溶质质量分数为27.4%。故填:27.4%。

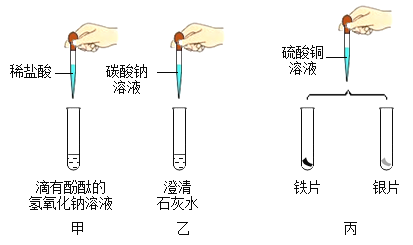
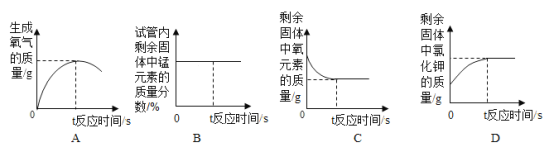
【题目】下列图像不能正确反映对应变化关系的是( )
|
|
|
|
A向一定量的稀盐酸中滴加氢氧化钠 溶液 | B将等质量的镁片和铁片投入到足量稀H2SO4 中 | C室温时,向一定量的稀盐酸中加入 少量镁条 | D向饱和的 Ca(OH)2溶液中加入一定量的CaO 固体 |
A.AB.BC.CD.D
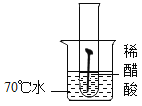
【题目】铁是当今世界上应用最广泛的金属
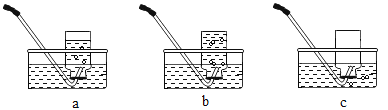
(1)铁与潮湿的空气接触易生锈。对铁锈蚀的影响因素进一步探究如下:
组别 | 1 | 2 | 3 | 4 | 5 |
图示 |
|
|
|
|
|
生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
通过上述第_____组对比实验能证明温度越高,铁钉生锈的速率越快。利用上述实验,还可得出的结论是_____。
(2)实验室以Fe2O3为原料模拟炼铁的化学方程式为_____。
(3)以Fe2O3为原料制备合成氨工业生产中所需的a-Fe催化剂(主要成分FeO、Fe2O3),原理为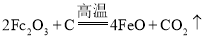 。当催化剂中FeO与Fe2O3的质量之比为9:20时,其催化活性最高。此时Fe2O3的转化率为_____( 精确到1%)。
。当催化剂中FeO与Fe2O3的质量之比为9:20时,其催化活性最高。此时Fe2O3的转化率为_____( 精确到1%)。