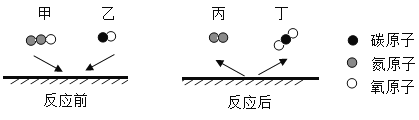
题目内容
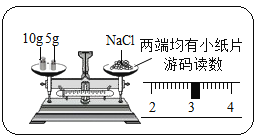
【题目】向一定量的硝酸铜、硝酸亚铁的混合溶液中加入 2.4g 镁粉,充分反应后过滤、洗涤、 干燥,称得固体 6g。则下列分析正确的是( )
A.滤液中一定不含有硝酸铜B.滤液中一定含有硝酸亚铁
C.滤出的固体中可能有铜无铁D.滤出的固体中可能只有铜和镁
【答案】A
【解析】
向一定量的硝酸铜、硝酸亚铁的混合溶液中加入 2.4g 镁粉,根据这三种金属的活动性顺序是![]() ,所以镁先与硝酸铜反应,如果硝酸铜反应完,镁再与硝酸亚铁反应。假设2.4g 镁粉全部与硝酸铜反应,生成铜的质量为X。
,所以镁先与硝酸铜反应,如果硝酸铜反应完,镁再与硝酸亚铁反应。假设2.4g 镁粉全部与硝酸铜反应,生成铜的质量为X。
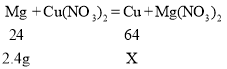
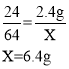
因为6.4g>6g,所以2.4g 镁粉没有全部参与硝酸铜反应,还有部分镁粉与硝酸亚铁反应,也就是说溶液中的硝酸铜已全部参与反应,滤溶液中一定不含硝酸铜,可能含有硝酸亚铁,一定含有硝酸镁,生成的固体中一定含有铜和铁,可能还有镁。
A、溶液中的硝酸铜已全部参与反应,滤液中一定不含有硝酸铜,符合题意;
B、滤液中可能含有硝酸亚铁,不符合题意;
C、滤出的固体中一定有铜和铁,不符合题意;
D、滤出的固体中一定有铜和铁,可能有镁,不符合题意。故选A。

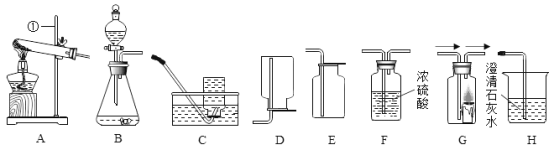
【题目】某兴趣小组的同学按照课本单元练习上的实验装置做“测定空气中氧气的体积分数”实验(如图1所示),但测出的氧气的体积分数明显小于理论值。请参与探究:
(1)提出问题:造成误差的原因是什么?如何改进课本上的实验装置?
(2)查阅资料:红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度/(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
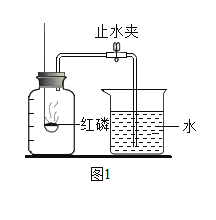
(3)猜想与假设:
①可能是导管内原来含有空气,后来又残留有吸入的水。
②你还能作出的猜想是_____、____。
(4)交流与讨论:
某同学认为可用木炭代替红磷来消除误差,他的猜想不合理的原因是______。
(5)探究与反思:
将铜粉放在残余气体中加热,观察到铜粉变黑色,说明__________。
(6)改进实验:
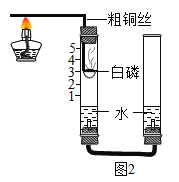
①他们对课本上的实验装置进行了图2所示的改进(其他图2仪器忽略),把红磷换为白磷理由是________。
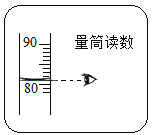
②大家用改进的实验装置(如图2所示)进行实验,待玻璃管冷却、管内白烟消失时,左玻璃管内的液面上升了___格,得到了较准确的结果。
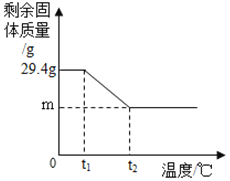
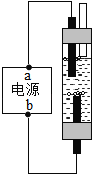
【题目】某学习小组利用如图所示装置对氯酸钾制氧气进行探究学习。
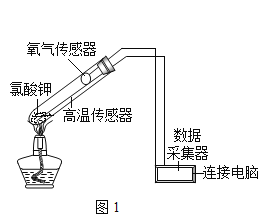
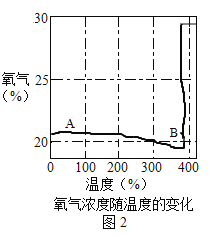
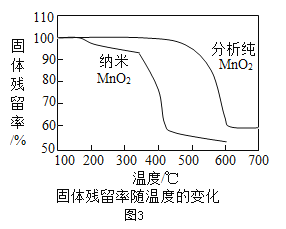
资料:①KClO3的熔点约为356℃,MnO2在加热条件下不分解;②KClO3分解时,传感器得到氧气浓度随温度的变化示意图及使用不同催化剂时的固体残留率分别如图和如图所示。
(1)由如图1可知,KClO3分解温度__________(填“高于”、“等于”或“低于”)其熔点。
(2)如图2中A→B段氧气浓度逐渐降低的可能原因是______________。
(3)分析如图3可知,对KClO3分解催化效果更好的催化剂是_____________。
(4)为证实MnO2的催化作用,小组同学利用如图装置进行如表所示的实验,请完成填表。
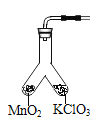
步骤 | 实验操作 | 实验现象 |
Ⅰ | 检查装置气密性 | (气密性良好) |
Ⅱ | 分别在“Y形管两支管中加入少量MnO2和KClO3,塞紧橡皮塞,用带火星木条放在导管口 | 没有_________ |
Ⅲ | 分别先后加热MnO2和KClO3,用带火星木条放在导管口,加热__________(填“左”或“右”)侧支管后,带火星木条复燃 | _________ |
Ⅳ | 冷却后,将"Y”形管左侧支管中部分MnO2混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口 | _________ |
(5)步骤Ⅳ的实验现象不能说明MnO2是KClO3分解的催化剂,因为还需要证明___________。
(6)将29.4gKC1O3和MnO2混合物以5:1配比加热至完全反应,如图中m的值应为_____g。