题目内容
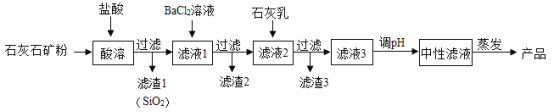
【题目】化学兴趣小组在实验室用大理石与4%的稀盐酸做二氧化碳制取实验,请你写出发生反应的化学方程式________________。当观察到试管中不再产生气泡时,发现固体还有剩余,小组同学对此进行探究( 杂质不溶于水且不与酸反应)。
[提出问题]不再产生气泡的原因是什么?
[查阅资料]氯化钙溶液显中性。
[作出猜想]
猜想1:盐酸已经完全反应。
猜想2:剩余固体中无碳酸钙。
猜想3:生成物或杂质附着在大理石表面,阻碍反应继续进行。
[实验一]探究反应后的溶液中是否有盐酸
(1)取上述反应后的清液,测得溶液pH=3,说明该溶液显_____________性,由此得出猜想1不成立的结论。
有的同学对此提出质疑,认为此结论不严谨,你认为这样质疑的理由是______。同学们经过讨论,一致认为通过实验1得出的结论不严谨,还需要通过完成实验2才能得出结论。
(2)另取洁净的试管,________________,测得溶液pH=5.6。
[得出结论]猜想1不成立。
[实验二]探究剩余固体中是否有碳酸钙
先振荡反应容器,使剩余固体与液体充分接触,发现仍无气泡产生,向容器中滴加少量4%的稀盐酸,发现又有气泡产生,且不再产生气泡时,仍有固体剩余。
[得出结论]猜想_______________不成立。
[分析讨论]综合实验一和实验二,导致气泡不再产生的原因是________________。
[反思提升](1)反应物的浓度也是影响反应能否进行的因素。(2)在探究反应后溶液显酸性或碱性的问题时,应注意的问题是________________。
【答案】![]() 酸 二氧化碳溶于水生成碳酸,使溶液也显酸性 注入适量蒸馏水,通入二氧化碳至饱和 猜想2、猜想3 盐酸浓度太小,反应不能进行 要同时考虑反应物和生成物对溶液酸碱性的影响
酸 二氧化碳溶于水生成碳酸,使溶液也显酸性 注入适量蒸馏水,通入二氧化碳至饱和 猜想2、猜想3 盐酸浓度太小,反应不能进行 要同时考虑反应物和生成物对溶液酸碱性的影响
【解析】
盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,书写化学方程式注意配平及气体符号,所以化学方程式为![]() ;
;
[实验一](1)根据溶液测定的pH为3,小于7,可以得出溶液显酸性,说明有剩余的盐酸,从而推出猜想1 不成立;由于反应后生成了二氧化碳,二氧化碳溶于水可以形成碳酸,碳酸显酸性,可使反应后的溶液显酸性,因此实验一不够严谨,需要排除二氧化碳的影响;
(2)为了验证二氧化碳溶于水是否使溶液呈酸性,所以需要设计实验,验证二氧化碳饱和溶液的pH值,因此取一只洁净试管,加入蒸馏水,通入二氧化碳至饱和,测试溶液pH值,说明二氧化碳溶于水,可以使溶液显酸性,但是最大pH为5.6,大于上述测定3,因此可以得出溶液中含有盐酸;
[实验二]根据实验一可知,溶液中含有盐酸,在充分震荡后,无气泡产生,再加入少量稀盐酸,产生气泡,说明碳酸钙与稀盐酸反应产生了二氧化碳,证明了碳酸钙的存在,猜想2不成立,此时说明溶液中有剩余的盐酸和碳酸钙,充分震荡不反应,说明内部残留的固体和表面附着物不影响反应,说明猜想3不成立,结合两者的实验现象得出猜想2和猜想3都不成立;
[分析讨论]根据实验一和实验二可知,内部还有残留的盐酸和碳酸钙,加入少量盐酸,反应可以继续进行,说明盐酸残留较少,加入少量盐酸,增加了盐酸浓度,反应就可以继续进行,因此盐酸浓度变小,抑制了反应的继续进行;
[反思提升]反应前的反应物若有剩余,对溶液pH有影响,同时反应后生成物若溶于水,形成溶液,也会影响反应后的溶液的pH值,所以在探究反应后溶液的pH的时候,需要同时考虑反应物和生成物对溶液酸碱性的影响。

【题目】一凡同学对生铁的组成进行研究,称取生铁样品 40g,把 500g 稀硫酸分 5 次加入样品中, 测得实验数据见下表:(杂质不溶于水,也不和稀硫酸反应)
实验序号 | 加入稀硫酸的质量/g | 剩余固体的质量/g |
第 1 次 | 100 | 28.8 |
第 2 次 | 100 | 17.6 |
第 3 次 | 100 | M |
第 4 次 | 100 | 1.2 |
第 5 次 | 100 | N |
(1)第 3 次剩余固体的质量 M=_____第 5 次剩余固体的质量 N=_____
(2)该生铁样品中铁的质量分数为_____。
(3)计算第 3 次反应结束后所得溶液的溶质质量分数。_____(写出计算过程,保留一位小数)