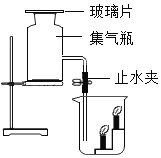
题目内容
【题目】现有氧化铜和铜的混合物,对其成分组成进行分析。取20g此样品,向其中分三次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的质量/g | 80 | 80 | 80 |
充分反应后剩余固体质量/g | 12 | 8 | m |
试回答下列问题:
(1)上述表格中m的值为______。
(2)所用稀硫酸的溶质质量分数为___?
(3)充分反应后所得硫酸铜溶液的溶质质量分数为____?(结果保留0.1%)
【答案】8 12.25% 14.0%
【解析】
解:第一次加入80g硫酸,固体减少了8g,第二次减少了4g,说明此时氧化铜已经完全反应,所以继续加入硫酸,固体质量不再减少,m=8。设所用稀硫酸中硫酸中溶质的质量分数为x,由于80g硫酸与8g氧化铜恰好完全反应。设此时生成硫酸铜的质量为y
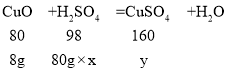
![]() ,解得x=12.25%,y=16g
,解得x=12.25%,y=16g
8g氧化铜生成16g硫酸铜,则12g氧化铜对应生成硫酸铜的质量为24g,充分反应后所得硫酸铜溶液的溶质质量分数为:![]()
答:(1)上述表格中m的值为8。
(2)所用稀硫酸的溶质质量分数为12.25%。
(3)充分反应后所得硫酸铜溶液的溶质质量分数为14.0%。

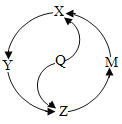
【题目】在一个密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物质 | X | Y | Z | Q |
反应前的质量/g | 35 | 8 | 2 | 5 |
反应后的质量/g | 待测 | 1 | 42 | 3 |
下列说法正确的是 ( )
A.该反应属于化合反应B.该反应中X与Z是生成物
C.该反应中X与Y发生变化的质量比为35:8D.该反应中生成42gZ物质
【题目】某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
(查阅资料)
a.经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。
b.铜、铁、铝都不溶于水;
c.硫酸铜、硫酸亚铁、硫酸铝都溶于水
(对比实验)
编号 | 操作 | 现象 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验_________(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为______,据此可知金属活动性Al比Cu____(填强”或“弱”)。
(3)根据所学的知识,小红设计了另一种判断铝和铜活动性强弱的方案,请你帮她填空
实验操作 | 实验现象 | 实验结论 |
将表面打磨过的铝丝和铜丝同时浸入到_____中 | _________ | 与上述实验结论相同 |
(4)在进行乙中实验的过程中,下列图像正确的是________
a. b.
b.
c. d.
d.
(拓展延伸)
小明同学提出一个问题:如果将铝粉和铁粉同时放入到一定量的硫酸铜溶液中,充分反应后所得固体是什么?
小红的猜想:只有铜 小宁的猜想:铜和铁
小童的猜想:铜、铁、铝 小红的猜想:铜和铝
上述猜想肯定错误的是________________的猜想。做出这种判断的依据是,在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的化合物溶液中置换出来。