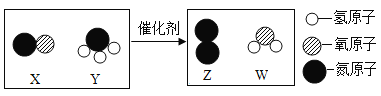
题目内容
【题目】某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
(查阅资料)
a.经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。
b.铜、铁、铝都不溶于水;
c.硫酸铜、硫酸亚铁、硫酸铝都溶于水
(对比实验)
编号 | 操作 | 现象 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验_________(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为______,据此可知金属活动性Al比Cu____(填强”或“弱”)。
(3)根据所学的知识,小红设计了另一种判断铝和铜活动性强弱的方案,请你帮她填空
实验操作 | 实验现象 | 实验结论 |
将表面打磨过的铝丝和铜丝同时浸入到_____中 | _________ | 与上述实验结论相同 |
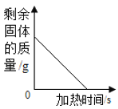
(4)在进行乙中实验的过程中,下列图像正确的是________
a. b.
b.
c. d.
d.
(拓展延伸)
小明同学提出一个问题:如果将铝粉和铁粉同时放入到一定量的硫酸铜溶液中,充分反应后所得固体是什么?
小红的猜想:只有铜 小宁的猜想:铜和铁
小童的猜想:铜、铁、铝 小红的猜想:铜和铝
上述猜想肯定错误的是________________的猜想。做出这种判断的依据是,在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的化合物溶液中置换出来。
【答案】甲 2Al +3CuSO4 =Al2(SO4)3 + 3Cu 强 稀盐酸(或稀硫酸) 铝丝表面产生气泡,铜丝表面无变化 d 小红
【解析】
(1)实验乙与实验甲比较说明打磨能破坏氧化铝薄膜。
(2)实验乙中,铝与硫酸铜反应生成铜和硫酸铝,反应的方程式为:2Al +3CuSO4 =Al2(SO4)3 + 3Cu。铝能把铜从硫酸铜中置换出来,说明铝比铜活泼。
(3)铝可以和稀盐酸反应,而铜不能与稀盐酸反应,故可以将将表面打磨过的铝丝和铜丝同时浸入到稀盐酸中,铝有气泡冒出,说明铝比氢强,铜没有气泡冒出,说明氢比铜强,说明铝比铜强。
(4)a、该反应的方程式为:2Al +3CuSO4 =Al2(SO4)3 + 3Cu,由方程式可知,该实验中减少的铝的质量54份而增加铜的质量为192份,故固体的质量增加,故错误;
b、反应刚开始固体的质量不为0,故错误;
c、由以上分析可知,固体的质量增加,故错误;
d、由分析可知,固体的质量增加,当反应停止后,固体的质量不变,故正确。故选d
(5)铝铁铜的活动性顺序为铝﹥铁﹥铜,故铝最先与硫酸铜反应,则一定有铜生成,当硫酸铜过滤,铝和铁都反应完后,固体只有铜。当铝完全反应,铁部分反应,则固体中有铁和铜;当硫酸铜的量很少,铝没有反应完全,铁没有反应,故固体有铝、铁、铜。如固体有铝,则铁没有反应,则一定有铁,故小红的猜想是错误的。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】现有氧化铜和铜的混合物,对其成分组成进行分析。取20g此样品,向其中分三次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的质量/g | 80 | 80 | 80 |
充分反应后剩余固体质量/g | 12 | 8 | m |
试回答下列问题:
(1)上述表格中m的值为______。
(2)所用稀硫酸的溶质质量分数为___?
(3)充分反应后所得硫酸铜溶液的溶质质量分数为____?(结果保留0.1%)
【题目】在一个堆放了一批袋装碳酸氢(NH4HCO3)化肥的小仓库里,过了一个夏天,管理员发现仓库里这种化学所特有的刺激性气味变得浓烈了。有些袋里的化肥变少了。检查发现变少了。检查发现:变少的化肥包裝袋上有少许破损.但没有发现化肥酒落在地上。化学活动小组为了探究化肥变少的原因提出了自己的猜想并设计了如图的实验。他们的实验记录如下表:
实验步骤 | 实验现象 |
取少量碳酸氢铵固体粉末放入蒸发皿中,并将蒸发皿放在酒精灯上加热 | ①白色固体逐渐消失;②____ |

(1)碳酸氢铵受热后分解,出现实验现象①的原因是___,若他们的猜想正确,实验现象②应为___
(2)写出该反应的化学方程式___
(3)碳酸氢铵应如何保存?____
(4)某固体物质受热后变化为态这种变化属于(_________)
A 一定是物理变化
B 一定是化学变化
C 可能是物理变化,也可能是化学变化
D 既不是物理变化也不是化学变化
(5)已知常见的相对原子质量有: H-I,C-12,N-I4,O-16通过计算写出结果
①碳酸氢铵的相对分子质量为:____
②各元素质量比为:_____
③氮元素的质量分数为(保留到0.001 ):____
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(图一)。
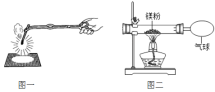
(1)请写出镁条与氧气反应的化学方程式_____________。
(2)经测量发现燃烧产物的质量_______(填“大于”“小于”或“等于”)镁条的质量,分析可知出现这一结果的原因是_________。
(3)兴趣小组按图二装置改进实验后,验证了质量守恒定律,同时发现燃烧产物中有少量黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体,常温下与水不反应;②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体为Mg3N2
(进行实验)同学们通过实验对猜想进行了验证,请你将实验记录表补充完整
实验操作 | 实验现象 | 结论 |
将镁粉燃烧的产物放在一只试管中,加入少量的蒸馏水,然后将一湿润的红色石蕊试纸放在试管口,观察现象 | _______ | 黄色固体 为氮化镁 |
(反思与交流)空气中氮气的含量远大于氧气的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,是因为 ___________。镁条_________(填“能”或“不能”)代替红磷做测定空气中氧气含量的实验,因为________________。