题目内容
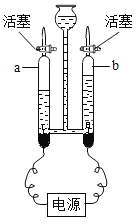
【题目】某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如下图所示。请回答有关问题:
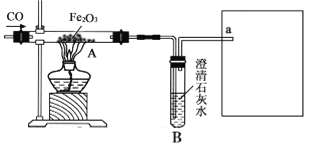
(1)为避免一氧化碳污染空气,a处应该如何处理____。
(2)实验开始时,先通CO,目的是____。
(3)实验进行一段时间后,玻璃管A中出现的现象为_____,由此可推断出一氧化碳的化学性质具有_____性。
【答案】放燃着的酒精灯 排尽装置内的空气防止爆炸 红色固体变黑 还原
【解析】
(1)为避免一氧化碳污染空气,需要在a处进行尾气处理,因一氧化碳具有可燃性,可在a处放一盏燃着的酒精灯,故填写:放燃着的酒精灯;
(2)实验开始时,先通CO,目的是排尽装置内的空气防止一氧化碳与空气混合受热爆炸,故填写:排尽装置内的空气防止爆炸;
(3)实验进行一段时间后,玻璃管A出现的现象为:红色粉末变为黑色,故填写:红色固体变黑;
玻璃管A中红色粉末变为黑色,是因为氧化铁被一氧化碳还原为铁,说明一氧化碳具有还原性,故填写:还原。

【题目】某班同学按下图所示的实验探究质量守恒定律。
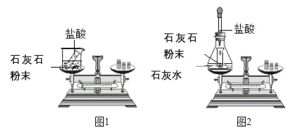
(1)同学们先按图1的方式实验,该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是_____(填字母)。
A | B | C | D | |
盐酸加入CaCO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
盐酸加入CaCO3粉末后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴入盐酸,最终天平的状态是_____(填字母)。
A 左盘高
B 右盘高
C 保持平衡
(3)该实验中通过化学反应新生成的物质有_____、_____(填字母)。
A HCl
B CO2
C CaCO3
D NaOH
【题目】现有氧化铜和铜的混合物,对其成分组成进行分析。取20g此样品,向其中分三次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的质量/g | 80 | 80 | 80 |
充分反应后剩余固体质量/g | 12 | 8 | m |
试回答下列问题:
(1)上述表格中m的值为______。
(2)所用稀硫酸的溶质质量分数为___?
(3)充分反应后所得硫酸铜溶液的溶质质量分数为____?(结果保留0.1%)
【题目】在一个堆放了一批袋装碳酸氢(NH4HCO3)化肥的小仓库里,过了一个夏天,管理员发现仓库里这种化学所特有的刺激性气味变得浓烈了。有些袋里的化肥变少了。检查发现变少了。检查发现:变少的化肥包裝袋上有少许破损.但没有发现化肥酒落在地上。化学活动小组为了探究化肥变少的原因提出了自己的猜想并设计了如图的实验。他们的实验记录如下表:
实验步骤 | 实验现象 |
取少量碳酸氢铵固体粉末放入蒸发皿中,并将蒸发皿放在酒精灯上加热 | ①白色固体逐渐消失;②____ |

(1)碳酸氢铵受热后分解,出现实验现象①的原因是___,若他们的猜想正确,实验现象②应为___
(2)写出该反应的化学方程式___
(3)碳酸氢铵应如何保存?____
(4)某固体物质受热后变化为态这种变化属于(_________)
A 一定是物理变化
B 一定是化学变化
C 可能是物理变化,也可能是化学变化
D 既不是物理变化也不是化学变化
(5)已知常见的相对原子质量有: H-I,C-12,N-I4,O-16通过计算写出结果
①碳酸氢铵的相对分子质量为:____
②各元素质量比为:_____
③氮元素的质量分数为(保留到0.001 ):____