题目内容
【题目】据《自然》杂质报道,科学家最近研制出一种以元素Sr(锶)的原子做钟摆的钟是世界上最精确的钟。元素Sr形成的粒子结构示意图如图1所示。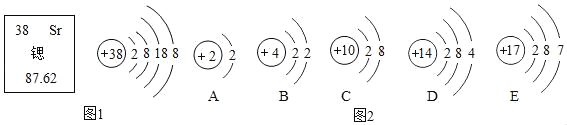
(1)Sr属于_____(填“金属”或“非金属”)元素。
(2)如图2结构示意图所表示的粒子的化学符号是_____。
(3)Sr元素的相对原子质量为_____。
(4)如图2表示的微粒中,具有相对稳定结构的是_____(填序号,下同),与Sr化学性质相似的是_____。
【答案】金属 Sr 87.62 AC B
【解析】
(1)由锶元素的名称带金字旁可,锶元素属于金属元素,故填金属.
(2)图中锶的结构示意图中,质子数等于电子数,是锶原子,直接用元素符号表示为:Sr,故填Sr。
(3)根据元素周期表中元素信息最下面的数是相对原子质量,所以Sr原子的相对原子质量是87.62,故填87.62。
(4)A原子的最外层的电子数(是第一层)为2是相对稳定结构,C是原子失去电子形成的离子,最外层是稳定结构,故填AC;
元素的化学性质是由最外层电子数决定的,即最外层电子数相同的原子化学性质相似,由图1可知,锶原子的最外层电子数为2,与A、B原子最外层电子数相同,但A只有一个电子层,最外层电子数2为稳定结构,所以锶和B的化学性质相似,故填B。

【题目】“卓筒井”是手工制盐的活化石,是我国古代劳动人民勤劳、智慧的象征。其工艺流程包括下面五个步骤:钻井→汲卤→晒卤→滤卤→煎盐。请回答下列问题:
(1)上述步骤中,_____与实验室过滤的原理一样,“煎盐”和实验室_____结晶的原理相同。
(2)“汲卤”获得卤水主要成分是氯化钠与氯化钾,卤水中氯化钠的质量分数大约为 7%~10%,“晒卤”目的是_____;“煎盐”得到的食盐中含有氯化钾,实验室可用_____检验,操作方法是_____。
(3)下列数据是氯化钠和氯化钾固体在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 g/100g 水 | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
根据表中数据可得出:40℃时,氯化钠溶解度_____氯化钾溶解度(填:大于、小于、等于); 氯化钠与氯化钾溶解度相同的温度范围是_____;20℃时,100g 卤水氯化钠的质量分数为 9%,含氯化钾 1.00g,蒸发掉水大于_____g,开始有氯化钠析出。
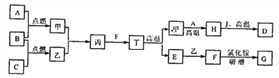
【题目】某化工厂用废硫酸制备K2SO4的流程如下:
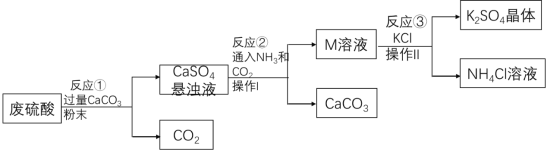
(l)生产上将CaCO3研成粉末的目的是_____;写出反应①的化学方程式:_____,操作I的名称是_____。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是_____(写化学式)。
(3)写出反应③的化学方程式:_____,反应③在常温下能实现的原因是_____。(反应③中相关物质的溶解度见下表)
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(4)洗涤反应③所得晶体不用水而用饱和K2SO4溶液的目的是_____。