题目内容
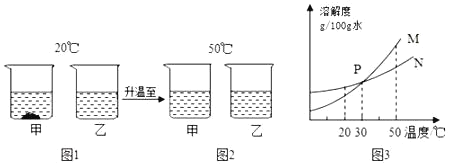
【题目】某化学实验小组探究碱的化学性质.
(1)A实验的现象是_______________________;
(2)B实验中发生的化学反应方程式为_____________________;
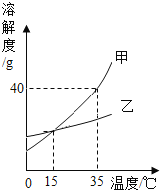
(3)实验结束后将所有物质倒入同一个废液缸中,发现底部有沉淀,上层溶液呈红色,取上层红色溶液加入过量的稀盐酸,根据反应现象得到了如图所示的实验现象.
①加入稀盐酸后产生的气体是___________;
②废液缸中上层红色溶液中含有的溶质是_______________________.
【答案】滴有酚酞的氢氧化钠溶液变为无色 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 二氧化碳 氢氧化钠和碳酸钠
【解析】
(1)当盐酸恰好和氢氧化钠溶液反应时,生成的氯化钠呈中性,A实验的现象是滴有酚酞的氢氧化钠溶液变为无色;
(2)B实验中,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)①分析图像数据得出,加入稀盐酸时先和氢氧化钠反应,氢氧化钠完全反应后,产生气体,说明溶液中含有碳酸钠,碳酸钠和稀盐酸反应生成二氧化碳、氯化钠和水,则气体是二氧化碳;
②分析图像数据得出溶液中一定存在氢氧化钠和碳酸钠,溶液中含有碳酸钠时,一定不含有氢氧化钙,这是因为碳酸钠和氢氧化钙不能共存,因此废液中使酚酞溶液变红的物质一定是氢氧化钠和碳酸钠。废液缸中上层红色溶液中含有的溶质是氢氧化钠和碳酸钠。

【题目】(1)某研究性学习小组为验证“氨气还原氧化铜”的实验,认真阅资料并做出以下准备。
资料准备:I.氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,溶液呈碱性。
Ⅱ.氨气还原氧化铜的化学反应原理:2NH3+3CuO![]() 3Cu+N2+3H2O。
3Cu+N2+3H2O。
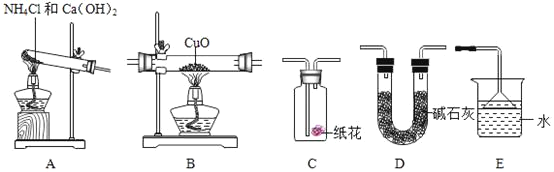
实验准备:
请回答:
①为达成“氨气还原氧化铜”的实验目的,装置A、B、D、E的正确连接顺序_____;(填序号)
②装置A中发生反应的化学方程式_____;
③装置B观察到的现象_____,装置E的作用_____;
④将装置A产生的气体通入装置C中,石蕊试液浸泡的纸花变蓝色,原因是_____。
(2)金属镁可与热水反应生成氢氧化镁和氢气,所得溶液呈碱性,可使酚酞溶液显紅色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
①镁与热水反应的化学方程式是_____。
②查阅资料:溶液红色褪去的原因是溶液碱性减弱。
(提出问题)导致溶液碱性减弱的原因是什么?
(假设与分析)
假设1:可能是氢氧化镁与N2或O2发生了反应。
假设2:可能是溶液吸收了空气中的_____。
假设3:可能是氢氧化镁的溶解度随温度的降低而_____。
由碱的性质可知,假设1不成立。
(实验探究)
实验操作 | 实验现象 | 结论 |
(1)取上述红色溶液,保持温度不变,在空气中放置一段时间,观察现象。 | _____ | 假设2成立 |
(2)取上述红色溶液,_____,_____,观察现象。 | 红色褪去 | 假设3成立 |
(拓展延伸)
③将一小块金属钠投入硫酸铜溶液时,产生蓝色沉淀。
请解释其原因:_____。
④除上述金属外,根据金属活动性顺序,预测_____也能跟硫酸铜溶液反应产生上述现象(举一例即可)。