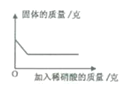
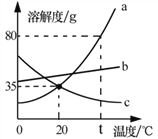
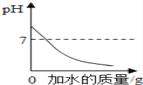
题目内容
【题目】在下面物质转化的关系图中,A、B、C、D是初中化学中常见的单质;甲、乙是酒精燃烧时产生的两种物质;丁是常用建筑材料的主要成分;G为无色有刺激性气味的气体,能使紫色石蕊溶液变蓝;J是赤铁矿的主要成分。
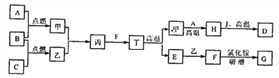
(1)写出化学式:乙是___________,G是__________________;
(2)写出H与J反应的化学方程式:_________________________________;
(3)J溶解于稀盐酸中,溶液呈黄色,反应完全后,再向所得溶液中加入足量纯净的D的粉末,溶液逐渐变成浅绿色,写出有关变化的方程式:___________。
【答案】 H2O NH3 Fe2O3+3CO![]() 2Fe+3CO2 Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Fe=3FeCl2
2Fe+3CO2 Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Fe=3FeCl2
【解析】根据丁是常用建筑材料的主要成分和碳酸钙的用途可知:丁是碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,甲和乙是酒精燃烧的产物,酒精燃烧生成二氧化碳和水,由图示和上述转化关系可知甲是二氧化碳,进而确定乙是水,其化学式为H2O,E是氧化钙,由图示可知A+B ![]() 甲,C+B
甲,C+B![]() 乙,由于甲是二氧化碳,乙是水,因此可以确定B是氧气,进而确定单质A是碳,单质C是氢气,由图示可知甲+乙→丙,由于甲是二氧化碳,乙是水,因此可以确定丙是碳酸,由图示可知丙+F→丁,由于丙是碳酸,丁是碳酸钙,因此可以确定F是氢氧化钙,由图示可知甲+A→H,由于甲是二氧化碳,A是碳,因此可以确定H是一氧化碳,由图示可知H+J→D,由于H是一氧化碳,J是赤铁矿的主要成分氧化铁,D是单质,因此可以确定D是铁,该反应中一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,该反应的化学方程式为:Fe2O3+3CO
乙,由于甲是二氧化碳,乙是水,因此可以确定B是氧气,进而确定单质A是碳,单质C是氢气,由图示可知甲+乙→丙,由于甲是二氧化碳,乙是水,因此可以确定丙是碳酸,由图示可知丙+F→丁,由于丙是碳酸,丁是碳酸钙,因此可以确定F是氢氧化钙,由图示可知甲+A→H,由于甲是二氧化碳,A是碳,因此可以确定H是一氧化碳,由图示可知H+J→D,由于H是一氧化碳,J是赤铁矿的主要成分氧化铁,D是单质,因此可以确定D是铁,该反应中一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,该反应的化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2。F+氯化铵
2Fe+3CO2。F+氯化铵 ![]() G,由于F是氢氧化钙,G是无色有刺激性气味的气体,能使紫色石蕊溶液变蓝,因此可以确定G是氨气,其化学式为NH3;通过检验知道上述的推断都是正确的。J溶解于稀盐酸中,溶液呈黄色,由于氯化铁溶液呈黄色,因此说明氧化铁与稀盐酸反应生成了氯化铁和水;该反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;再向溶液中加入纯净的D(铁)的粉末,溶液逐渐变成浅绿色,由于氯化亚铁溶液呈浅绿色,因此说明铁与氯化铁反应生成了氯化亚铁,该反应的化学方程式为:2FeCl3+Fe=3FeCl2。
G,由于F是氢氧化钙,G是无色有刺激性气味的气体,能使紫色石蕊溶液变蓝,因此可以确定G是氨气,其化学式为NH3;通过检验知道上述的推断都是正确的。J溶解于稀盐酸中,溶液呈黄色,由于氯化铁溶液呈黄色,因此说明氧化铁与稀盐酸反应生成了氯化铁和水;该反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;再向溶液中加入纯净的D(铁)的粉末,溶液逐渐变成浅绿色,由于氯化亚铁溶液呈浅绿色,因此说明铁与氯化铁反应生成了氯化亚铁,该反应的化学方程式为:2FeCl3+Fe=3FeCl2。

 寒假学与练系列答案
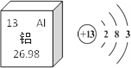
寒假学与练系列答案【题目】工业上用闪锌矿(主要含ZnS,还含PbS等杂质)制备锌的流程如下(部分产物略去):
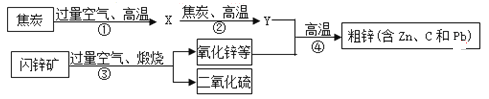
(1)X的化学式是_______,图中用过量空气的目的是_________。
(2)①~④中属于化合反应的是______。
(3)Zn______(填“能”或“不能)与PbCl2溶液反应。
(4)写出反应③中生成ZnO的化学方程式_________。
(5)结合下表数据设计:从粗锌中分离出纯锌的方案是_________。
物质 | Zn | Pb | C |
沸点℃ | 907 | 1749 | 4827 |
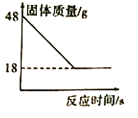
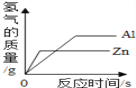
(6)反应②中固体质量随反应时间的变化图示如下图,计算产生Y的质量__________。(写出必要的计算过程)