��Ŀ����
����Ŀ�������г������ʵ����ʺ�ʵ���ǻ�ѧ�о�����Ҫ���ݣ�

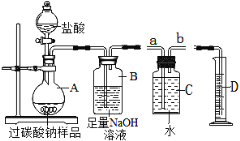
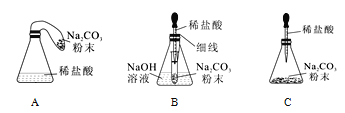
��1������һƿ������ͼ��ʾ���Ȼ�����Һ��С��ͬѧ���Ƶ��Ȼ�����Һ��������ƫС�ˣ� ��д���������п��ܳ��ֵĴ���_____��______________________����ʾ��1g ���������룬������ �㣩������ 15%���Ȼ�����Һ������ 500g ������������Ϊ 0.9%���Ȼ�����Һ����Ҫ��ˮ ������Ϊ___________________��
��2��ͬѧ�ǰ���ͼ��ʾ��ʵ����ɺ����ν���Һ��������ͬһ�ྻ���ձ��У����㵹Һ ��ʱ���۲쵽��Һ�������ݲ�����
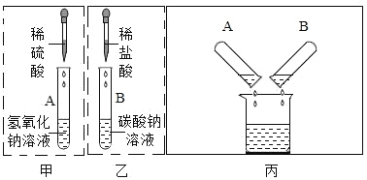
������ȷ����A �Թ��з�Һ���������_____________________________ ��д��ѧʽ����ͬ����B�Թ��з�Һ���������___________________________________��
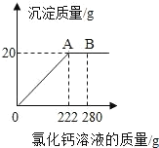
��3��������ʽ�����Ƽ���ƵõĴ�����������Ȼ��ƣ�Ϊ�ⶨij������Ʒ��̼���Ƶ� ������ȡ 23g ��Ʒ�����ձ��У���ˮ�����ܽ⣬�ٵμ��Ȼ�����Һ������������������� ���Ȼ�����Һ��������ϵ��ͼ��ʾ����ô�����Ʒ��̼���Ƶ���������_______________________�����������һλС ���㣩
���𰸡������Ȼ���ʱ�������� ��ȡҺ��ʱ���ӿ̶� 470g H2SO4��Na2SO4 Na2CO3��NaCl 92.2%
��������
��1������һƿ������ͼ1��ʾ���Ȼ�����Һ��С��ͬѧ���Ƶ��Ȼ�����Һ��������ƫС�ˣ��������������˻����ܼ����ˣ������������п��ܳ��ֵĴ��� �����Ȼ���ʱ���������ȡҺ��ʱ���ӿ̶ȣ�����15%���Ȼ�����Һ������500g������������Ϊ0.9%���Ȼ�����Һ����Ҫ��ˮ������Ϊ500g��![]() ��470g��
��470g��
��2���������������Ʒ�Ӧ���������ƺ�ˮ��̼���������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��̼���������ᷴӦ���������ơ�ˮ�Ͷ�����̼�����㵹Һ��ʱ���۲쵽��Һ�������ݲ�����˵��̼���ƺ�������ʣ�࣬����A�Թ��з�Һ��������� H2SO4��Na2SO4��B�Թ��з�Һ��������� Na2CO3��NaCl��
��3���裺�ô�����Ʒ��̼���Ƶ���������Ϊx��

![]() x��92.2%��
x��92.2%��

 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д� ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д�����Ŀ����������ʦ����ѧ��̽���������غ㶨�����Ľ�ѧƬ�Σ��������̽������æ��д�ո�
��������⣩��ѧ��Ӧǰ������ʵ������ܺ��Ƿ���ȣ�
����������裩�������ȣ� ��������;
��ʵ��̽�����ס�������ͬѧ��������ƽ�ֱ������Ӧǰ�����ʵ�������
�� �� | �� �� | |
ʵ�鷽�� ����Ӧ���ԣ� |
|
|
ʵ������ | �����ݲ�������ƽָ������ƫת | ���������к�ɫ������������Һ��ɫ�����ı䣬��ƽָ��û��ƫת |
���� | �������ȷ | �������ȷ |
����˼���ۣ��������ֲ�����ȷ��ͨ�����ۣ�ͬѧ�Ƿ��ּ��������������������ָ������ƫת���õ���ʾ����̽����ѧ��Ӧǰ������ʵ������ܺ��Ƿ����ʱ���������������ɻ�μӵķ�Ӧһ��Ҫ��____�н��С�
���Ż�װ�ã�ͬѧ�ǶԼ��������еķ�Ӧװ�ý������������ָĽ�������Ϊ���װ����_____������
�ţ�������������װ������ѡһ��ָ���䲻��__________��
���ó����ۣ�ͬѧ�����øĽ�������װ�ý����ٴ�̽�������ó��������ȷ����һ���������֣���Ӧ��ϵ�����ĺ�δ�μӷ�Ӧ�����ʵ������ڷ�Ӧǰ�ֲ��䣬���յó������ǣ��μӻ�ѧ��Ӧ�ĸ����ʵ������ܺ͵��ڷ�Ӧ�����ɵĸ����ʵ������ܺ͡�
������Ӧ�ã����ͣ���ѧ��Ӧǰ��ԭ�ӵ����ࡢ��Ŀ�����������䣬���������غ㡣
Ӧ�ã�ij�����������Ȼᷢ���ֽⷴӦ����������ͭ��ˮ�Ͷ�����̼�������ʣ���ù�������һ����_______��Ԫ����ɡ�