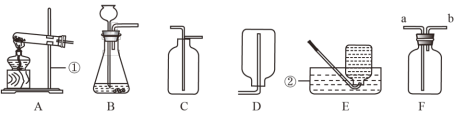题目内容
【题目】某小组对过氧化氢溶液制取氧气进行了如下探究:
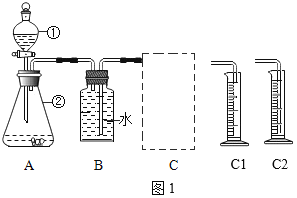
(探究一)探究不同催化剂对H2O2分解速率的影响该小组采用了如图1所示装置进行实验,实验中催化剂均为0.4g,H2O2溶液均为20mL,浓度均为10%。在C框中连接导管和量筒,并测量收集到50mL水时的某项数据,经计算后绘制出下表:
催化剂种类 | 气体产生速率(mL/s) |
二氧化锰 | 3.5 |
氧化铜 | 4.5 |
活性炭 | 5.8 |
(1)检查A装置气密性的方法是:用弹簧夹夹住A装置右侧胶皮管,打开①上方的塞子,向其中加水,打开①的活塞,若_____,则气密性良好。
(2)装置A中发生的反应化学方程式为_____,C框内应选用_____(填“C1”或“C2”)装置。
(3)该探究实验中,需要测定的数据是_____。
(4)从实验数据可知:相同条件下,表中催化剂的催化效果由强到弱依次为_____。
(5)当量筒中收集到50mL水时,H2O2分解产生的氧气体积_____50mL(填“<”、“>”或“=”)。
(探究二)探究MnO2的用量对H2O2分解速率的影响,图2甲所示装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比。反应放热忽略不计)

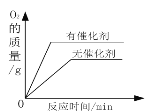
(1)图2乙是“0.1gMnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出_____。
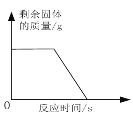
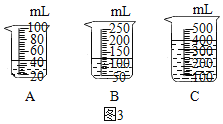
(2)当用“3%H2O2溶液8毫升与不同质量的MnO2混合”时,得到如图丙所示的曲线。曲线的斜率显示,当MnO2的用量增加到0.08g时,H2O2的分解速率达到实验要求。在此实验条件下,若MnO2的质量为4g(一药匙)时,能使图3中_____(选填字母)烧杯中所装的3%H2O2溶液中H2O2的分解速率最接近实验要求。
(探究三)探究H2O2溶液的浓度对H2O2分解速率的影响,
如图4所示,在250mL三颈瓶中均加入0.5gMnO2,在恒压漏斗中各加入20mL不同浓度的H2O2溶液,分别进行实验。用温度传感器测量并绘制出瓶内温度与时间的关系图。如图5①所示。再将该装置的三颈瓶浸入水浴池中(该池可使瓶内的溶液温度恒定在20℃),用上述实验中相同量的各物质重复上述实验,用气压传感器测量并绘制出瓶内气压与时间的关系图,如图5所示。
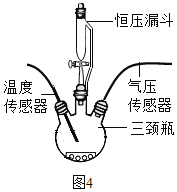
(1)实验中,恒压漏斗的作用是_____。
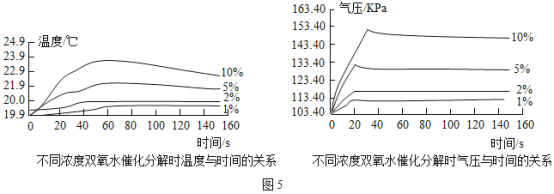
(2)由图①知道:H2O2分解时会_____热量(填“放出”或“吸收”)。
(3)由图②知道:H2O2溶液浓度越高,H2O2分解速率越_____(填“快”或“慢”)。以10%H2O2溶液为例,约25s后三颈瓶内气压由高缓慢降低的原因是_____。
(反思与总结)影响H2O2分解速率的因素,除了催化剂的种类、催化剂的用量、H2O2溶液的浓度外,还可能有_____
【答案】分液漏斗中水不留下 2H2O2![]() 2H2O+O2↑ C2 收集50mL氧气所需要的时间 活性炭、氧化铜、二氧化锰 < 过氧化氢溶液越多,产生氧气越多 C 使恒压漏斗与三颈瓶内气压相等,便于过氧化氢溶液顺利下滴 放出 快 反应结束,放热停止,随着装置散热,温度会下降,使得三颈瓶内气压开始缓慢减小 催化剂颗粒大小 过氧化氢溶液的温度
2H2O+O2↑ C2 收集50mL氧气所需要的时间 活性炭、氧化铜、二氧化锰 < 过氧化氢溶液越多,产生氧气越多 C 使恒压漏斗与三颈瓶内气压相等,便于过氧化氢溶液顺利下滴 放出 快 反应结束,放热停止,随着装置散热,温度会下降,使得三颈瓶内气压开始缓慢减小 催化剂颗粒大小 过氧化氢溶液的温度
【解析】
探究一(1)检查A装置气密性的方法是:用弹簧夹夹住A装置右侧胶皮管,打开①上方的塞子,向其中加水,打开①的活塞,锥形瓶中的压强不变,若分液漏斗中水不留下,则气密性良好。
(2)装置A中过氧化氢分解反应化学方程式为:2H2O2![]() 2H2O+O2↑,C2装置中玻璃导管伸入量筒底部,防止液体飞溅,C框内应选用C2装置;
2H2O+O2↑,C2装置中玻璃导管伸入量筒底部,防止液体飞溅,C框内应选用C2装置;
(3)该探究实验中,需要测定的数据是:收集50mL氧气所需要的时间;
(4)从实验数据可知:相同条件下,表中催化剂的催化效果由强到弱依次为:活性炭>氧化铜>二氧化锰;
(5)当量筒中收集到50mL水时,则B装置内的气体中含有一部分空气体积,所以H2O2分解产生的氧气体积<50mL;
探究二(1)图2乙是“0.1gMnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出:过氧化氢溶液越多,产生氧气越多;
(2)当MnO2的用为0.08g时,用“3%H2O2溶液8毫升混合”时,H2O2的分解速率达到实验要求。在此实验条件下,若MnO2的质量为4g时,烧杯中所装的3%H2O2溶液中体积为:V=![]() 时,H2O2的分解速率最接近实验要求。
时,H2O2的分解速率最接近实验要求。
探究三(1)实验中,恒压漏斗的作用是:使恒压漏斗与三颈瓶内气压相等,便于过氧化氢溶液顺利下滴;
(2)由图①知道:H2O2分解时会放出热量;
(3)由图②知道:H2O2溶液浓度越高,H2O2分解速率越快,以10%H2O2溶液为例,约25s后三颈瓶内气压由高缓慢降低的原因是:反应结束,放热停止,随着装置散热,温度会下降,使得三颈瓶内气压开始缓慢减小;

 计算高手系列答案
计算高手系列答案