题目内容
【题目】兴趣小组在做完盐的性质实验后,发现一瓶碳酸钠固体可能混入了氯化钠、硫酸钠中的一种或两种。为此,他们取少量该样品于试管中,加入足量的水,溶解后进行了下列探究。
(实验验证)
实验步骤 | 现象 | 结论、分析及化学方程式 |
(1)滴入过量的稀硝酸,再滴入过量的硝酸钡溶液。 | 有气泡产生,____ | 说明该固体中没有硫酸钠。 |
(2)再继续滴入几滴硝酸银溶液。 | 有白色沉淀生成 | 说明该固体中______。实验结束所得溶液中一定含有的阳离子是______。 |
(实验反思)
(1)步骤(1)中先加入过量的稀硝酸的目的是______,写出该反应的化学方程式_______。
(2)步骤(1)中为什么不用稀盐酸______。
(3)写出步骤(2)的方程式_______。
【答案】未产生白色沉淀 有NaCl H+,Na+,Ba2+ 除尽Na2CO3 ![]() 以免引进Cl-,干扰对NaCl的检验
以免引进Cl-,干扰对NaCl的检验 ![]()
【解析】
实验步骤
(1)滴入过量的稀硝酸,稀硝酸与碳酸钠反应产生二氧化碳气体,再滴入过量的硝酸钡溶液。若没有白色沉淀产生,说明该固体中没有硫酸钠。因为硫酸钠与硝酸钡能产生硫酸钡沉淀;
(2)再继续滴入几滴硝酸银溶液。氯化钠与硝酸银反应能产生氯化银白色沉淀,有白色沉淀生成,说明该固体中有氯化钠。实验结束所得溶液中一定稀硝酸、硝酸钡硝酸钠,其中含有的阳离子是:H+、Na+、Ba2+;
(1)步骤(1)中先加入过量的稀硝酸的目的是:除尽Na2CO3,防止碳酸根与钡离子反应产生碳酸钡白色沉淀,干扰实验现象;稀硝酸与碳酸钠反应产生硝酸钠、水和二氧化碳的化学方程式![]() 。
。
(2)步骤(1)中为什么不用稀盐酸的原因: 若加入稀盐酸,引进氯离子,干扰对NaCl的检验;
(3)步骤(2)氯化钠与硝酸银反应产生硝酸钠和氯化银白色沉淀的化学方程式:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】氢能源是21世纪的绿色能源,氢能电池和氢能汽车被公认为最重要的战略新兴产业。当前制取氢气成本太高,科学家研究出如图1所示高效、经济的两种制氢途径。

(1)途径1:用二氧化钛作催化剂,利用太阳能分解水,从能量转换的角度看,该过程主要由太阳能转化为______能。其中二氧化钛中钛元素的化合价为____。
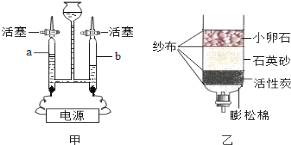
(2)途径2:通过光电转化装置提供电能,电解水。如图2是化学家为了揭示水的组成,完成电解水的实验。
①在该实验中,通常会加入少量的硫酸钠的目的是_______。一段时间后,可观察到电极上产生无色气泡,甲、乙试管中收集到的气体体积比为___,接口b处应接电源___(填“正”或“负”)极。
②请你设计验证乙管生成的气体:
实验步骤 | 现象 | 得出的结论 |
_______ | _______ | _______ |
(3)氢能是最具有发展前景的终极能源。请说明其优点为________(一点即可)。