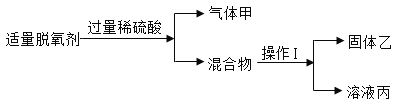
题目内容
【题目】高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
(1)写出制取高铁酸钠的化学方程式:______;
(2)在制取高铁酸钠的反应中______元素被氧化;
(3)高铁酸钠之所以有净水作用,除杀菌外,另一个原因是______。
【答案】2Fe(NO3)3+16NaOH+3Cl2 2Na2FeO4+6NaNO3+6NaCl+8H2O Fe(或铁) Fe3+可发生水解,生成Fe(OH)3胶体,它可吸附水中悬浮的杂质或泥沙胶粒等一起凝聚而沉降,达到净水的效果
2Na2FeO4+6NaNO3+6NaCl+8H2O Fe(或铁) Fe3+可发生水解,生成Fe(OH)3胶体,它可吸附水中悬浮的杂质或泥沙胶粒等一起凝聚而沉降,达到净水的效果
【解析】
(1)硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠,反应的化学方程式为:2Fe(NO3)3+16NaOH+3Cl2 2Na2FeO4+6NaNO3+6NaCl+8H2O;
2Na2FeO4+6NaNO3+6NaCl+8H2O;
(2)在制取高铁酸钠的反应中,铁的化合价由+3价升高到+6价,铁元素被氧化;
(3)高铁酸钠之所以有净水作用,除杀菌外,另一个原因是Fe3+可发生水解,生成Fe(OH)3胶体,它可吸附水中悬浮的杂质或泥沙胶粒等一起凝聚而沉降,达到净水的效果。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
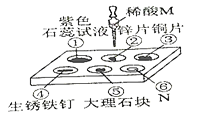
轻巧夺冠周测月考直通高考系列答案【题目】果果将自制的紫色紫薯汁(见图)分别滴加到五支不同溶液的试管中,观察到的现象如下表所示:
溶液 | 白醋 | 盐酸 | 食盐水 | 草木灰水 | 石灰水 |
加入紫薯汁后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |

(1)图中存放紫薯汁的仪器名称____________;
(2)据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸可能显示的颜色是_______。
(3)若将盐酸逐滴滴入滴有紫薯汁的石灰水中直至过量,你看到的溶液颜色变化过程是_____,发生反应的化学方程式为___________________。
【题目】宏宏同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,宏宏邀约几个喜欢探究的同学对此进行了探究。请你一起完成下列实验报告。
(1)(提出问题1)
该溶液是否变质?
(实验探究1)
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有_____产生 | 说明该溶液已变质。变质的原因是_____(请用化学方程式表示)。 |
(2)(提出问题2)
该溶液变质程度怎样?
(提出猜想)
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有_____。
(查阅资料)
氯化钡溶液呈中性。
(实验探究2)
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有_____生成 | 猜想_____成立 |
静置,取上层清液于另一支试管中,加入2﹣3滴酚酞溶液 | 上层清液变红 |
(3)(提出问题3)
怎样提纯该样品得到纯净的氢氧化钠固体。
(实验探究3)
为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图实验方案。
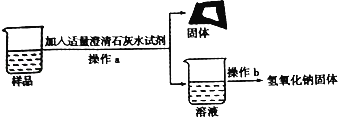
请回答下列问题:
①操作a和操作b中都需用到玻璃棒,其中操作a中玻璃棒的作用为_____。
②根据实验流程可知,最终所得氢氧化钠固体质量_____变质后样品中氢氧化钠的质量(填“大于”、“小于”或“等于”)。
(4)(反思交流)
在(实验探究2)中加入过量的氯化钡溶液的目的是什么?_____。
【题目】兴趣小组在做完盐的性质实验后,发现一瓶碳酸钠固体可能混入了氯化钠、硫酸钠中的一种或两种。为此,他们取少量该样品于试管中,加入足量的水,溶解后进行了下列探究。
(实验验证)
实验步骤 | 现象 | 结论、分析及化学方程式 |
(1)滴入过量的稀硝酸,再滴入过量的硝酸钡溶液。 | 有气泡产生,____ | 说明该固体中没有硫酸钠。 |
(2)再继续滴入几滴硝酸银溶液。 | 有白色沉淀生成 | 说明该固体中______。实验结束所得溶液中一定含有的阳离子是______。 |
(实验反思)
(1)步骤(1)中先加入过量的稀硝酸的目的是______,写出该反应的化学方程式_______。
(2)步骤(1)中为什么不用稀盐酸______。
(3)写出步骤(2)的方程式_______。